已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为 g,CO2的物质的量为 mol。
杜鹃素主要用于慢性支气管炎及其他痰多咳嗽病症,其结构简式如图所示,其中x、Y表示某种官能团或基团。请回答下列问题:
(1)杜鹃素的分子式可表示为 ,则杜鹃素的分为。
,则杜鹃素的分为。
(2)杜鹃素与足量氢氧化钠溶液完全反应,只生成一种有机化合物z和水,化合物Z的摩尔质量为366 g·mol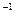 ,则杜鹃素分子中一Y的名称为。
,则杜鹃素分子中一Y的名称为。
(3)有机物A~H满足下列转化关系,芳香烃G的相对分子质量小于110,A与杜鹃素互为同分异构体。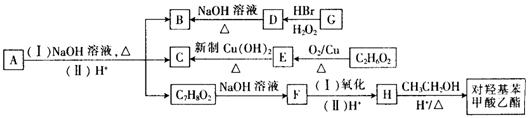
已知:CH3 H
H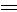 CH2+HBr
CH2+HBr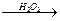 CH3CH2CH2Br
CH3CH2CH2Br
①G的名称为。
②反应D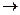 B的化学方程式为
B的化学方程式为 。
。
③A长期露置于空气中容易变质,从分子结构上看,A具有抗氧化作用,则A的结构简
式为。
④符合下列条件的对羟基苯甲酸乙酯的同分异 构体有种(对羟基苯甲酸乙酯自身除外)。
构体有种(对羟基苯甲酸乙酯自身除外)。
Ⅰ.苯环上含有两个对位取代基Ⅱ.能发生水解反应且能与FeCl3溶液发生显色反应
多羟基连在同一个碳原子上易自动失水生成醛或酮
(1)根据上述原理,请写出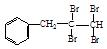 与NaOH的水溶液共热的化学方程式为:;
与NaOH的水溶液共热的化学方程式为:;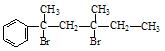 与NaOH的醇溶液共热可以生成种稳定的二烯烃。
与NaOH的醇溶液共热可以生成种稳定的二烯烃。
(2)醛酮在水中可生成水合物: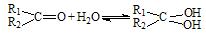 ;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若
;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若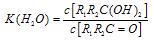 为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
| 化合物 |
  |
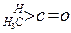 |
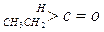 |
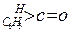 |
| K(H2O) |
2×103 |
1.3 |
0.71 |
8.3×10-3 |
| 化合物 |
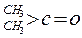 |
 |
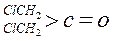 |
 |
| K(H2O) |
2×10-3 |
2.9 |
10 |
很大 |
根据以上表中数据分析,请总结出两条结论:
①。
②。
(3)工业上生产苯甲醛 有以下两种方法:
有以下两种方法:
与方法①相比,方法②的优点是,
缺点是。
(4)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为;
反应②的反应类型属于。
(5)由对苯二甲醛的氧化产物“对苯二甲酸”与“乙二醇”缩聚,生成的聚酯纤维(涤纶)
的结构简式为。
异丙苯(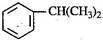 ),是一种重要的有机化工原料。
),是一种重要的有机化工原料。
根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是。
(3)α-甲基苯乙烯(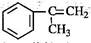 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
(4)耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯共聚生成,写出该树脂的结构简式(不考虑单体比例)。
化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出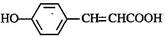 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g)+148.9 kJ
SiF4(g)+ 2H2O(g)+148.9 kJ
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
a.2v正(HF)=v逆(H2O)b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。