一定条件下,向2L恒容密闭容器中加入2molX、1 molY,发生如下反应:2X(g) + Y  3Z(g);△H =" -a" kJ/mol (a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
3Z(g);△H =" -a" kJ/mol (a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
下列说法中错误的是
| A.用Z表示的化学反应速率为1.2 mol·L—1·min—1 |
| B.若再充入1 mol Z,重新达平衡时,X的体积分数不变,则Y为气态 |
| C.达平衡后,实际放出的热量为b kJ,则b=a |
| D.若使容器体积变为1L,Z的物质的量不会增大 |
某温度下,已知反应mX(g)+nY(g) qZ(g)ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是( )
qZ(g)ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是( )
| A.通惰性气体增大压强,平衡正向移动 |
| B.再加入X,反应吸收的热量增大 |
| C.增加Y的物质的量,X的转化率减小 |
D.降低温度,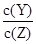 的值变小 的值变小 |
向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的pH变化情况正确的是()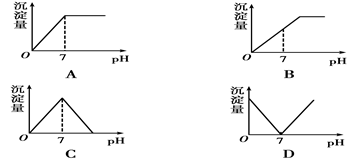
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是()
| A.由水电离的c(H+):①=②>③=④ |
| B.将①、③两种溶液等体积混合后,pH可能不等于7 |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是()
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是()
| A.c(H+)随着温度的升高而降低 | B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 | D.水的电离是个吸热过程 |
室温时将PH=5的硫酸溶液稀释1000倍后,则c(H+):c(SO42-)是()
| A.2:1 | B.21:1 | C.20:1 | D.22:1 |