氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强
C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率 ,该温度下,反应的平衡常数K= 。
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)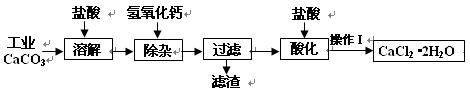
(1)CaCO3与盐酸反应的离子方程式。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
①,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括、、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为。
(1)大气中SO2含量过高会导致雨水中含有 (填化学式)而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为。
(2)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
 (3)合成氨的反应N2(g)+3H2(g)
(3)合成氨的反应N2(g)+3H2(g)  2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a.升高温度b.加入催化剂 c.增加H2的浓度
d.增加N2的浓度e.分离出NH3  (4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(16分)从樟科植物枝叶提取的精油中含有甲、乙两种成分:
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):
反应I的反应类型为,Y的结构简式。
(3) 1mol乙最多可与 molH2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式。
从樟科植物枝叶提取的精油中含有甲、乙、丙三种成分:
(1)由甲转化为乙的过程(已略去无关产物):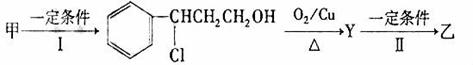
反应Ⅰ和反应Ⅱ的反应类型为和,Y的结构简式 。
。
(2)已知:
由乙制取丙的路线如下(A—E均为有机物,Mr表示相对分子质量):
①由乙转化为D的化学方程式。
②D有多种同分异构体,请任写其中一种能同时满足下列条件的异构体的结构简式 。
。
a.苯环上有三个不同官能团 b.能发生银镜反应
c.能与 发生加成反应 d.遇
发生加成反应 d.遇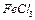 溶液显示特征颜色
溶液显示特征颜色
③E中含氧官能团的名称分别为和,丙的结构简式。
标准状况下,向1 00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 |
V(A)=0 |
0<V(A)<150 |
V(A)=150 |
150<V(A)<300 |
| 溶质的成分 |
① |
② |
③ |
④ |
(3)取V(A)="100" mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是。