选修《化学与技术》
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
⑴该泉水属于 硬水(填写“暂时”或“永久”)。
⑵若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
⑶目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
⑷岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式: ;
阴极区的现象是: 。
带支链的烷烃A(C6H14)只可能有三种一氯取代产物B、C和D,以上反应及B、D的进一步反应如下图所示。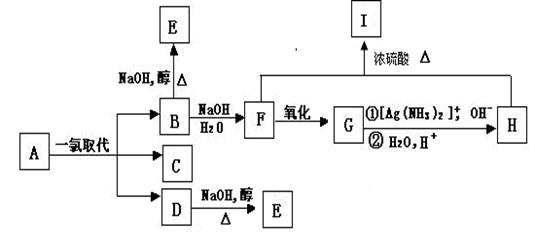
请回答:
(1)A的名称是,Ⅰ的分子式是 。
(2)写出下列反应的化学方程式:
B→F______________________________________________________________;
D→E______________________________________________________________。
(3)某一有机物X是H的同分异构体,可发生下列变化: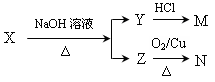
已知M、N均不发生银镜反应,则X的可能结构有_____________种;
写出Z可能的结构简式:_____________________________________________。
某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2):
X+Y Z+H2O
Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是(填标号字母)。
(2)Y的分子式是,可能的结构简式是:和。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得到F(C4H8O3)。F可发生如下反应:F
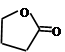 + H2O
+ H2O
该反应的类型是,E的结构简式是。
有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。
(1)B中的含氧官能团名称是。
(2)A→C的反应类型是;A~D中互为同分异构体的是(填代号)。
(3)由A生成B的化学方程式是。
(4)C在一定条件下发生加聚反应的化学方程式是。
如图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。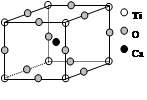
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有、个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是。该物质的化学式可表示为。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为g/cm3(阿伏加德罗常数用NA表示)。
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 发生化学反应的产物。
发生化学反应的产物。
(1) 甲一定含有的官能团的名称是________________________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是___________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)
___________________________________________________________________。
(4)已知:RCH2COOH RCHCOOHCl
RCHCOOHCl
RONa ROR′ (R—,R′—代表烃基)
ROR′ (R—,R′—代表烃基)
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)________。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是______________,反应Ⅱ的反应类型是______________。
③反应Ⅳ的化学方程式是__________________________________________________________。