如图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。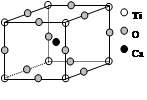
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 。该物质的化学式可表示为 。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为 g/cm3(阿伏加德罗常数用NA表示)。
工业上将磷酸钙、石英砂和炭粉混在电弧炉中焙烧来制取白磷:
Ca3(PO4)2+SiO2+C—CaSiO3+P4+CO↑
(1)配平以上方程式
Ca3(PO4)2+ SiO2+C=CaSiO3+P4+ CO↑
(2)已知白磷熔点为44.1℃,熔点280℃,据此判断其晶体类型属于
(3)有一种磷的结构式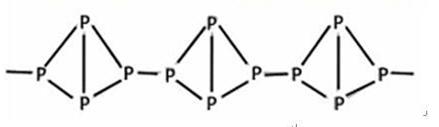 ,
,
有关它的叙述肯定不正确的是
| A.它在空气中完全燃烧的产物是P2O5 | B.它不溶于水 |
| C.它在常温下呈固态 | D.它与白磷互为同分异构体 |
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于(填编号)
A.破坏臭氧层 B.光化学烟雾 C.造成酸雨
(2)下列关于NO的说法不正确的是
A.NO为无色气体
B.NO在空气中很不稳定
C.NO是汽车尾气的有害成分之一
D.NO分子所含电子总数为偶数
(3)在含Cu+离子的酶的活化中,亚硝酸根 (NO2—)离子可转化为NO ,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:
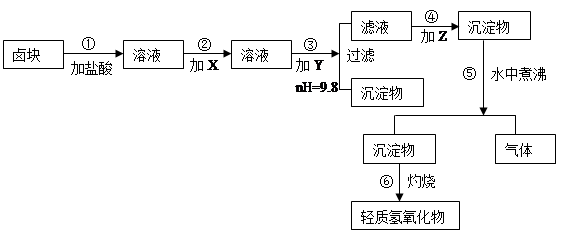
表1 化学试剂价格表
| 试剂 |
价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
表2 生成氢氧化物沉淀的值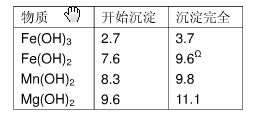
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9. 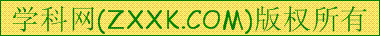 6 6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。请填写以下空白:
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的
是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题: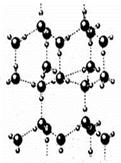
(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
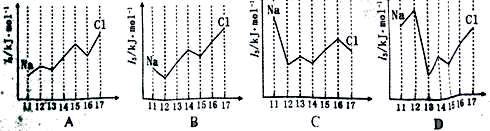
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。