亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
| 步骤Ⅰ |
称取样品Wg于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ |
向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
| 步骤Ⅲ |
用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: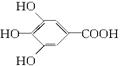
(1)用没食子酸制造墨水主要利用了___________类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________________________________________________。
(3)尼泊金丁酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_____________________________,其苯环只与—OH和—COOR两类取代基直接相连的同分异构体有_____________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:______________________。
某一定量的苯的同系物完全燃烧,生成的气体通过浓硫酸后,质量减少10.8 g,再通过KOH溶液后,KOH溶液增重39.6 g,又知经氯代处理后该苯的同系物苯环上的一氯代物、二氯代物、三氯代物分别有一种,该苯的同系物的分子式为_______________,结构简式为______________________________。
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8 g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式_______________;B可能的分子式_______________。
(2)若n(A)∶n(B)=1∶1时,A的名称_______________;B的名称_______________。
(3)若n(A)∶n(B)≠1∶1时,
A的结构简式为______________________________;
B的结构简式为______________________________;
则n(A)∶n(B)=______________________________。
卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应。其实质是带负电的原子团(如OH-等阴离子)取代了卤代烃中的卤原子。例如CH3CH2CH2—Br+OH-→CH3CH2CH2—OH+Br-。
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应______________________________________________________。
(2)碘甲烷跟CH3COONa反应_________________________________________________。
(3)由碘甲烷,无水乙醇和金属钠合成甲乙醚(CH3OCH2CH3)____________________。
A、B、C、D四种有机物的化学式均为C3H6O2,试根据下列性质确定它们的结构式:
(1)A既能跟金属钠起反应又能跟Na2CO3溶液起反应:______________________________。
(2)B既能发生银镜反应又能发生水解反应:__________________________________。
(3)C只能发生水解反应生成两种有机物:__________________________________。
(4)D既能发生银镜反应又能发生酯化反应:__________________________________。