300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: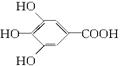
(1)用没食子酸制造墨水主要利用了___________类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________________________________________________。
(3)尼泊金丁酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_____________________________,其苯环只与—OH和—COOR两类取代基直接相连的同分异构体有_____________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:______________________。
钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用资源。已知: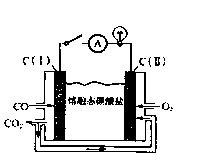
①3Fe2O2(s)+CO(g) 2Fe3O2(s)+CO2(g) △H=—47kJ/mol
2Fe3O2(s)+CO2(g) △H=—47kJ/mol
②Fe3O3(s)+3CO(g)  2Fe(s)+3CO2(g) △H=—25kJ/mol
2Fe(s)+3CO2(g) △H=—25kJ/mol
③Fe3O\4(s)+CO(g)  3FeO(s)+CO2(g) △H=+19kJ/mol
3FeO(s)+CO2(g) △H=+19kJ/mol
(1)试计算反应:FeO(s)+CO(g) Fe(s)+CO2(g)的△H=。已知1092℃该反应的平衡常数为0.357,则1200℃时该反应的平衡常数0.357(填“>”“=”或“<”),在1L的密闭容器中,投入7.2gFeO和0.1molCO2加热到1092℃并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为。
Fe(s)+CO2(g)的△H=。已知1092℃该反应的平衡常数为0.357,则1200℃时该反应的平衡常数0.357(填“>”“=”或“<”),在1L的密闭容器中,投入7.2gFeO和0.1molCO2加热到1092℃并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为。
(2)炼钢尾气净化后,可直接作熔融碳酸盐燃料电池(工作原理如右图)的燃料,则负极的电极反应为。
(3)转炉炼钢,尾气中CO体积分数达58%—70%,某钢厂先用NaOH吸收CO生成甲酸钠,再吸收SO2生成保险粉(Na2S2O3),试写出甲酸钠和氢氧化钠混合溶液与SO2生成保险粉同时生成二氧化碳的化学方程式。
(4)在550—650℃时,尾气烟尘中的Fe2O3与CO及H2气体可用于合成炼钢原料Fe3C,该反应的化学方程式为。
(5)目前我国大多数企业是将CO转换为H2,然后用H2与N2反应合成氮,若收集到3360m2尾气,其中CO体积分数为60%,由于循环操作,假定各步转化率均为100%,理论上可获得NH31。
全矾液流电池是一种新型电能储存和高效转化装置,其电解质溶液为VOSO4溶液,该电解质溶液可通过下列方法制取:将18.2gV2O5和30mL浓H2SO4加入到40mL水中,并在充分搅拌下在水浴上加热20min。向溶液中加水稀释至375mL,通SO2至悬浮液变成深蓝色溶液。将此溶液蒸发浓缩至原体积的五分之一,通入足量的CO2。再将溶液煮沸后,用稀释至1000mL,全矾液流电池的工作原理为VO2++H2O+V2+  +V2++2H+。
+V2++2H+。
(1)通入SO2发生反应的化学方程式为。
(2)通入SO2的目的是。
(3)全矾液流电池充电时,阳极的电极反应式为。
(4)某溶液中含有VO2+、Cr2O32—,现向此溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+ →VO2+,Cr2O32—→ Cr3+。再滴入2.00mL,0.020mol/LKMnO2溶液,又恰好使VO2+ →VO2+,而Cr3+不变,试求溶液中Cr的质量(mg).
白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg(SiO10)(OH)3]来制取,其主要工艺流程如下: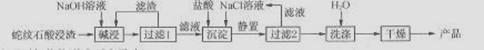
(1)蛇纹石用氧化物形式可表示为。
(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①;②(任举两种)。
(3)过滤1得到的滤液的主要成分是。
(4)沉淀时加入氯化钠溶液的作用可能是。
(5)洗涤时,如保证明产品已洗涤干净?。
I、磷、硫元素的单质和化合物应用广泛。
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO
每生成1mol P4时,就有__________mol电子发生转移。
(2)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:C6H8O6+I2 C6H6O6+2H++2I-2
C6H6O6+2H++2I-2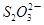 +I2
+I2
 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
(3)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2 +5
+5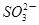 +2H+
+2H+ I2+5
I2+5 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: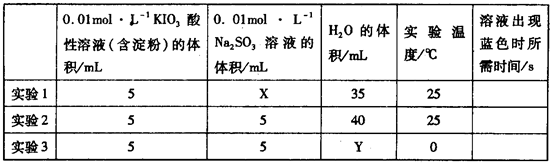
该实验的目的是______________;表中X=__________mL
Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(4)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是_______________________.
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式: Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1moleO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________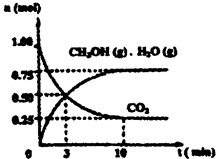
②下列措施中一定不能使CO2的转化率增大的是______________。
| A.在原容器中再充入lmolCO2 |
| B.在原容器中再充入1molH2 |
| C.在原容器中充入lmol氦气 |
| D.使用更有效的催化剂 |
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L
的NaOH溶液,所得溶液中离子浓度由大到小的顺序为
_______________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________(填“甲醇”或“氧气”),其电极上发生的电极反应式为____________。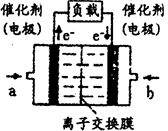
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。