2014年10月24日,我国探月工程三期再入返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空。火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出该反应的氧化剂: ;K2S的电子式为 ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式: ;
实验二:取黑火药爆炸反应后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊(S)后又变澄清(SO42-)。请设计实验方案证明该澄清溶液中含有Cl-: ;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4C1O4)、铝粉复合推进剂。高氯酸铵水溶液呈酸性的原因是 ;(用离子方程式表示)
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮;可燃物有肼(N2H4)、偏二甲肼等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,则它的分子式为 。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。

接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:_____________。
(3)写出乙烧杯的电解池反应_____________________________。
(4)若电解后甲溶液 的体积为25L,则该溶液的pH为___________ 。
的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入_______ g 。(填写化学式)
乙偶姻是一个极其重要的香料品种。乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1 ,乙偶姻中含有碳氧双键。与乙偶姻有关的反应如下: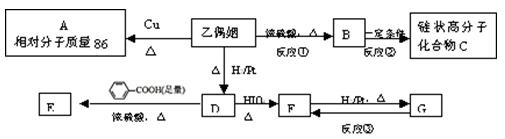
已知:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,写出其所有可能结构简式________。
(3)写出反应①、③的反应类型:① ___________、③ ___________。
(4)A的一氯代物只有一种。写出下列物质的结构简式:
A ___________________、乙偶姻 __________________、C_________________。
(5)写出D → E反应的化学方程式_______________________________________。
恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气) C(气)。
C(气)。
I(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。平衡时,B的物质的量____________(选填一个编号)
(甲)大于2mol(乙)等于2mol
(丙)小于2mol(丁)可能大于、等于或小于2mol
作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)
(甲)a<b(乙)a>b(丙)a="b" (丁)不能比较a和b的大小
作出此判断的理由是_______________________________。
A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) =" 2" (a+c) =" 3" (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为,构成D单质的元素在周期表中位于周期族。
(2)反应③的离子方程式为E的氧化物与D在一定条件下反应的化学方程式为:。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为。
(12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。