工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现 向
向 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+  O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s |
0 |
2 |
3 |
4 |
| c(NO)/mol·L-1 |
1.00×10-3 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 |
|
 |
 2.70×10-3 2.70×10-3 |
|
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
(15分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO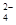 |
NO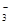 |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: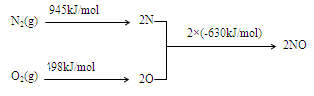
① N2(g)+O2(g)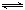 2NO(g)△H= 。
2NO(g)△H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
(14分)氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下: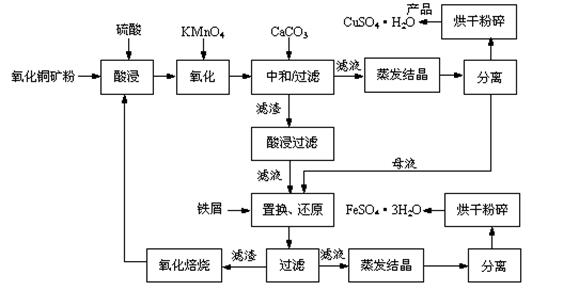
(1)氧化铜矿石粉碎的目的是。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式。
(3)“中和/过滤”中加入CaCO3的目的是。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有。
(5)加入铁屑的作用是、。
(6)表2和图6为“烘干粉碎”的试验结果。
| 序号 |
t/h |
t/℃ |
m/g |
x |
| 1 |
3 |
80 |
5 |
4 |
| 2 |
3 |
160 |
10 |
1 |
| 3 |
4 |
160 |
10 |
0.8 |
| 4 |
4 |
160 |
5 |
0 |
| 5 |
5 |
80 |
5 |
3 |
| 6 |
5 |
160 |
15 |
1 |
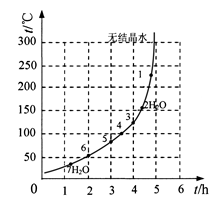
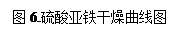
表2中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水得流程中所示产品的适宜工艺条件分别为,(分别指出两条件的温度和时间)。
(12分)二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: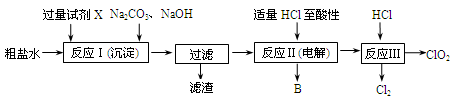
(1)粗食盐水中含有Ca2+、Mg2+、SO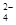 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO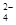 ,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O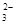 =2I-+S4O
=2I-+S4O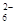 )
)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
实验室配制480mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500 mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度l~2 cm处,改用胶头滴管小心滴加适量的蒸馏水后停止滴加;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)_______。
(2)实验中用托盘天平称取NaCl晶体的质量是________。
(3)上述操作步骤③中定容时,如果加水超过了刻度线,应如何处理?________。
(4)若实验时出现如下情况,对所配溶液浓度将有何影响?(选填“偏高”、“偏低”、“无影响”)
①定容时,仰视刻度线:_______。
②移液后,未洗涤烧杯和玻璃棒:_______。
③容量瓶中原来有少量水:。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+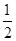 O2(g) = H2O(g)△H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g)△H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。