(12分)二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: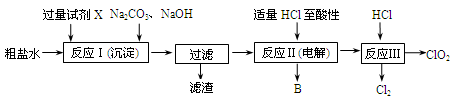
(1)粗食盐水中含有Ca2+、Mg2+、SO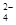 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO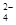 ,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O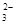 =2I-+S4O
=2I-+S4O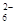 )
)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
已知由短周期元素组成的A、B、C、D、E五种化合物,它们所含原子数目依次为2、3、4、5、6,其中A、B、C、E含有18个电子,D含有10个电子。请回答:
(1)A的化学式是:,用电子式表示B的形成过程。
(2)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,化学方程式是。
(3)若C为第一和第二周期元素组成的化合物,在C的溶液中加入少量二氧化锰,有无色气体生成,则C分子中化学键的类型有。
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: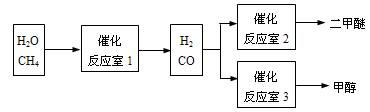
请填空:
(1)写出二甲醚完全燃烧生成二氧化碳和水的化学反应方程式:
__________________________________________________________________。
(2)写出用CO和H2合成甲醇的化学方程式:___________________________________。
(3)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) 。
CO(g)+3H2(g) 。
将1.0 molCH4和2.0 molH2O通人反应室1(容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(CH4)=_______________________。
Ⅰ.由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36 L(标准状况)的气体。问: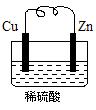
(1)负极是(填“锌”或“铜”),发生反应(填“氧化”或“还原”)。
(2)正极的电极反应为
(3)产生这些气体共需转移电子mol。
Ⅱ.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: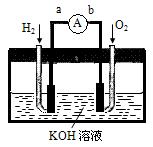
(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理为:Ⅰ.2Li+H2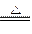 2LiHⅡ.LiH+H2O===LiOH+H2↑
2LiHⅡ.LiH+H2O===LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。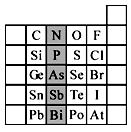
(1)阴影部分元素N在元素周期表中的位置为周期族。根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________;在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
以下是元素周期表的一部分,回答下列有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
⑴写出⑥的元素符号:,⑧的离子结构示意图,②的单质的电子式,①的氢化物结构式。
⑵在这些元素中,最不活泼的元素是(用元素符号作答)。
⑶在这些元素的最高价氧化物对应的水化物中,酸性最强的是;(用化学式作答,下同)碱性最强的是;呈两性的氢氧化物的是。
⑷在这些元素中,原子半径最大的是(用元素符号作答)。
⑸这些元素中形成的碱性最强的碱与呈两性的氢氧化物恰好反应的离子方程式是
。