元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。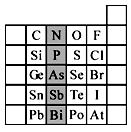
(1)阴影部分元素N在元素周期表中的位置为 周期 族 。根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________;在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
下图是元素周期表的前四周期的结构,请回答
| A |
|||||||||||||||||
| B |
C |
D |
|||||||||||||||
| E |
F |
G |
|||||||||||||||
| H |
|||||||||||||||||
⑴请写出各元素的元素符号:A、B、C、D、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式,指出化合物M中的化学键类型。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
⑴一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。若反应物的总能量(填“>”、“<”、“=”)生成物的总能量,该反应就放出能量;若反应物的总能量生成物的总能量,该反应就吸收能量。
⑵普通锌锰酸性干电池的内部结构如图所示,请回答
①该电池的负极材料为该电极反应为
②正极材料为,正极得到电子的氧化剂为
③电解质为
⑶化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。若时间用秒表示,则化学反应速率的单位是。
⑷在外界条件不变的情况下,一个可逆反应达到的最大限度是该反应达到状态。
⑴请写出下列物质的电子式:
①NaCl②H2O③NH4Cl④NaOH
⑵请用电子式表示下列物质的形成
①H2S
②CaO
请写出元素周期表中第3横行17纵行的元素,回答下列问题:
⑴该元素的符号是,其原子结构示意图为,属于元素(填“金属”或“非金属”)。
⑵该元素位于元素周期表第周期族,该族的名称为。
⑶请写出该元素的单质与下列物质反应的化学方程式
①水,
②氢氧化钠溶液,
③NaBr溶液,
分子式为C13H16O2惕各酸苯乙酯被广泛用作各类香精的调香剂,当其加入茉莉型或丁香型香精中时,能产生诱人的效果。为了合成该物质,某化工厂实验室的科研人员设计了下列合成线路: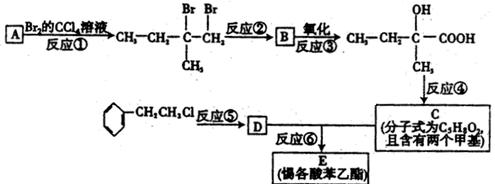
试回答下列问题:
(1)试写出,A的结构简式,B的结构简式。
(2)反应②另加的试剂是,反应④的一般条件是。
(3)试写出生成E的化学方程式:。
(4)上述合成线路中,属于取代反应的有(填编号)。