KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯(已知ClO2中 氯元素的化合价为+4价),其化学方程式为:
氯元素的化合价为+4价),其化学方程式为:
2KClO3 + 4HCl(浓) = 2KCl + 2ClO2↑ + Cl2↑ + 2H2O。
(1)浓盐酸在反应中表现出来的性质是 (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)该反应中:__________是氧化剂,__________是还原剂,__________元素被氧化,
__________元素被还原,__________是氧化产物,__________是还原产物,电子
转移总数为__________,当有1摩尔的氯气生成时,有__________摩尔的盐酸被
氧化,转移电子的物质的量为 mol。
(3)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以1g质量的
物质 得到的电子数)比Cl2 (填大、小或不变)。
得到的电子数)比Cl2 (填大、小或不变)。
[化学—选修2化学与技术](15分)空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下: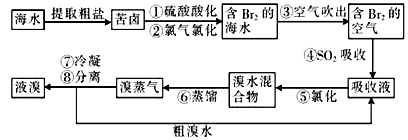
(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80〜90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①〜⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴____mol。
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?______________________
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
【改编】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
2H2(g)+O2(g)=2H2O(l) △H=—285.8 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
则反应CO(g)+2H2(g)=CH3OH(l)的△H=_______。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g)△H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g)△H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。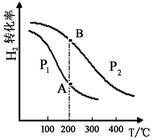
压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂B.降低温度C.增加H2的浓度
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。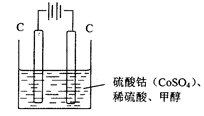
①写出阳极电极反应式___________________________________________;
②写出除去甲醇的离子方程式________________________________。
【化学——选修3:物质结构与性质】A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素。其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子。请回答下列有关问题:
(1)写出E的基态原子的价层电子排布式 ;
(2)AB2的水化物中A的杂化方式为 ,CD2的空间构型为 ;
(3)K3[E(CN)6](此处C为碳元素符号)中配位数为 ,配体的电子式为 ;
(4)某矿石主要成分甲的晶胞如图,甲能与水反应,则甲的化学式为 ,属于 晶体;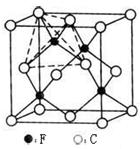
(5)CD2与CB3可以合成广泛用于有机合成的化合物CBD2,同时得到另一种与臭氧互为等电子体的化合物,写出该反应的化学方程式 ;
(6)纳米颗粒E3B4在磁性录像带、磁性存储器、磁性光盘、铁氧体磁芯、波导管和变压器等方面应用广泛,制取该颗粒时,将0.3mol/L ESO4的水溶液和0.4mol/L ECl3的水溶液以体积比2∶1进行混合。根据E3B4的组成分析按此用量混合可能的原因是 。
【化学——选修2:化学与技术】
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是()
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下: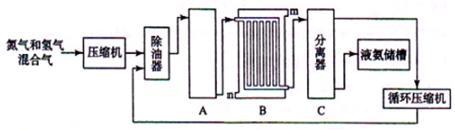
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)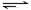 CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。