【化学——选修3:物质结构与性质】A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素。其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子。请回答下列有关问题:
(1)写出E的基态原子的价层电子排布式 ;
(2)AB2的水化物中A的杂化方式为 ,CD2的空间构型为 ;
(3)K3[E(CN)6](此处C为碳元素符号)中配位数为 ,配体的电子式为 ;
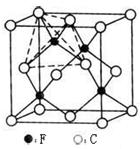
(4)某矿石主要成分甲的晶胞如图,甲能与水反应,则甲的化学式为 ,属于 晶体;
(5)CD2与CB3可以合成广泛用于有机合成的化合物CBD2,同时得到另一种与臭氧互为等电子体的化合物,写出该反应的化学方程式 ;
(6)纳米颗粒E3B4在磁性录像带、磁性存储器、磁性光盘、铁氧体磁芯、波导管和变压器等方面应用广泛,制取该颗粒时,将0.3mol/L ESO4的水溶液和0.4mol/L ECl3的水溶液以体积比2∶1进行混合。根据E3B4的组成分析按此用量混合可能的原因是 。
下图是中学化学中常见物质间的转化关系。其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1 mol E中含有 10 mol电子。乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色。
(1)写出化学式:甲_________ ;
乙________;丙_______;
(2)丁的摩尔质量为。
(3)写出丙和E反应生成A和B的化学方程式:。
(4)有学生将乙和丁混和加热后收集到标准状况下气体8.96 L ,测得该气体对氢气的相对密度为16,若将气体通入足量的澄清石灰水中,得到白色沉淀物g。
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25 ml沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是;他的操作中涉及到的化学反应方程式为。
(2)证明有Fe(OH)3胶体生成的实验操作及现象是。
(3)丁同学将所制得的Fe(OH)3胶体分成两份,并进行下列实验:
①将其中一份装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明。
②向另一份中不断滴加稀硫酸,观察到的现象是。
.[化学——选修5:有机化学基础]
已知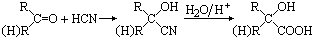 ,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
(1)A、E的结构简式分别为:、;
(2)B→C、E→F的反应类型分别为:、;
(3)写出下列转化的化学方程式:
C→D;
G+F→H;
(4)要检验B中的Br元素,可用的操作和现象为。
(5)写出符合下列要求的H的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2,。(只要求写出2个)
[化学——选修3:物质结构与性质](15分)前四周期原子序数依次增大的元素A、B、C、D中A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为。
(2)四种元素中第一电离能最小的是,电负性最大的是。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。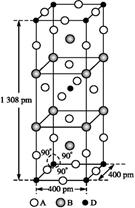
①该化合物的化学式为,D的配位数为;
②列式计算该晶体的密度g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有;
(5)该化合物中存在一个复杂离子,该离子的化学式为,配位体是。
[化学——选修2:化学与技术](15分)草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: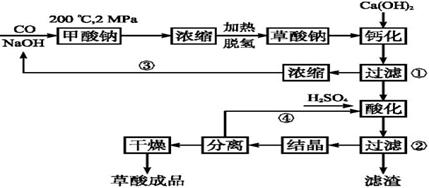
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为;列式计算该成品的纯度。