苯氯乙酮是一种具有荷花香味的有机物,其结构简式为: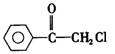 , 请回答下列问题:
, 请回答下列问题:
(1)苯氯乙酮的分子式为  。
。
(2)苯氯乙酮可能发生的化学反应类型有 (选填字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
(3)苯氯乙酮的同分异构体有多种,请写出同时符合下列三个条件的任意两种同分异构体的结构简式:
①分子内有苯环但不含甲基;②氯原子与链烃基直接相连;③能发生银镜反应。
、 。
(4)已知:①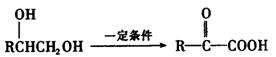
②通常状况下氯苯在氢氧化钠水溶液中不能发生水解反应。
苯氯乙酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂F,F的结构简式是: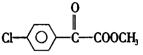 ,由M→F的转化关系如下:
,由M→F的转化关系如下: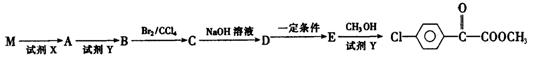
请回答:
①M的结构简式为 ,D中含氧官能团名称为 。
②A→B的化学反应方程式为 ;
E→F 的化学反应方程式为 。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5C1,则该产物的结构简式
为 。
I.氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和氢氧化钠固体,产生氨气的原因是: ;氨气的检验方法是: 。
通过如图装置(尾气处理装置已略去)验证了氨有还原性,硬质玻璃管中氨发生催化氧化反应的化学方程式为_________________________。
(3)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2气体为氧化剂。若1 g气体肼与NO2气体反应生成氮气和水蒸气放出a kJ热量,写出反应的热化学方程式______________________。反应中生成N2质量为42g,则转移电子的物质的量为________________。
II.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
I. (1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为 ,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
| 0min |
5min |
10min |
|
| CO |
0.01 |
0.0056 |
|
| H2O |
0.01 |
0.0156 |
|
| CO2 |
0 |
0.0044 |
|
| H2 |
0 |
0.0044 |
(1)请计算5min时H2O的平衡浓度__________。
(2)CO的平衡转化率为____________。
(3)若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
Cl2是重要的化工原料。
(1)写出用Cl2制备漂白液的离子方程式______________________。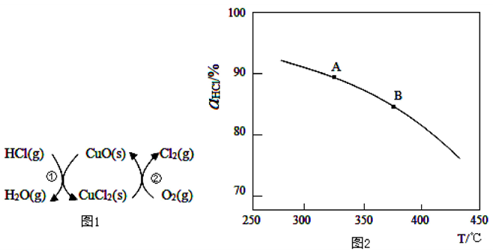
(2)图1所示的催化剂循环可实验用O2将HCl转化为Cl2,其中反应①为2HCl(g)+CuO(s)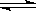 H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
(3)实验室模拟用O2将HCl转化为Cl2的总反应
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如图2所示,则总反应的△H_________0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 ,简要说明理由: 。
②在上述实验中若压缩体积使压强增大,在图2中画出相应ɑHCl—T曲线的示意图。
③为提高HCl的平衡转化率下列措施中可行的是 。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)
(2)溶液B中Na2SO4与NaOH的物质的量浓度之比 ,从90 mL至100mL之间加入10 mL B溶液时发生的离子反应方程式
(3)将A、B溶液中各溶质的物质的量浓度填入下表
| 溶质 |
Na2SO4 |
BaCl2 |
FeCl3 |
| C(mol/L) |
I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
(1)写出“氧化”过程中生成Na2FeO4的化学方程式 。
(2)“转化”过程中发生的化学反应方程式为 。