要从含Al3+、Fe3+、Ba2+、Ag+的溶液中分别沉淀出Fe3+、Ba2+、Ag+,加入试剂的顺序正确的是
| A.盐酸、稀硫酸、NaOH溶液 |
| B.NaOH溶液、盐酸、稀硫酸 |
| C.盐酸、稀硫酸、氨水 |
| D.盐酸、氨水、稀硫酸 |
H和F的原子半径( )
| A.大于 | B.小于 | C.等于 | D.不能肯定 |
在某密闭容器中有16L NO和 NH3的混合气体,在催化剂和加热条件下发生如下反应: 6NO + 4NH3 6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
①3:5②3:4③3:2④3:1
| A.①④ | B.②③ | C.①② | D.③④ |
已知:N2(g)+3H2(g)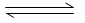 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是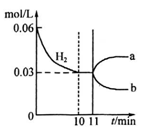
| A.10~11min该反应的速率为v(H2)>0.003mol/(L·min) |
| B.若改变所用催化剂时,△H 会发生变化 |
| C.若将上述密闭容器换作绝热密闭容器,其余条件不变,NH3的产率将降低 |
| D.从11min起其它条件不变,压缩容器的体积,则c(H2 )的变化曲线为b |
根据下列实验现象,所得结论不正确的是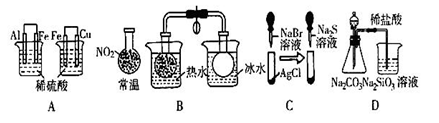
| 实验 |
实验现象 |
结论 |
| A |
左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
烧瓶内颜色深浅不同 |
说明:2NO2 N2O4(g) △H<0 |
| C |
白色固体先变为淡黄色,后变为黑色 |
溶度积(Ksp):AgCl>AgBr >Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
盐酸克伦特罗属于“瘦肉精”的一种,其结构简式如下图所示。关于盐酸克伦特罗的说法正确的是 
| A.属于芳香烃 |
| B.遇FeCl3溶液显紫色 |
| C.在一定条件下可以氧化为醛 |
| D.能发生加成反应、取代反应、消去反应 |