缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3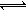 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
| A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系 |
下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
A. NH3、HD、C10H8 B.PCl3、CO2、CH3COONH4
C. NO、SiO2、P2O5 D.H2O2、CF2Cl2、B3N3H6
关于晶体的下列说法正确的是( )
| A.在晶体中只要有阳离子就一定要有阴离子 |
| B.在晶体中只要有阴离子就一定要有阳离子 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.分子晶体的熔点一定比金属晶体的低 |
下列各组物质中,按熔点由低到高排列的是( )
| A.O2、I2、Hg | B.CO2、KCl、SiO2 | C.Na、K、Rb | D.NaCl、KCl、RbCl |
向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述不正确的是( )
| A.先生成白色沉淀,加入足量氨水后沉淀消失 |
| B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
| C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl |
| D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
有关晶体的下列说法中正确的是( )
| A.晶体中分子间作用力越大,分子越稳定 | B.冰熔化时水分子中共价键发生断裂 |
| C.原子晶体中共价键越强,熔点越高 | D.氯化钠熔化时离子键未被破坏 |