近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其部分流程如下: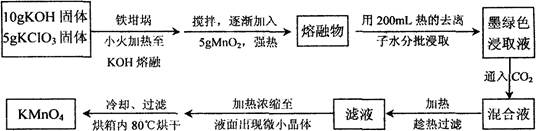
(1)实验中采用铁坩埚而不用瓷坩埚的原因是 ;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4的化学方程式 ;
(3)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,则K2MnO4完成反应时,转化为KMnO4的百分率约 (精确至0.1%)
(4)若通入CO2太多,则在加热浓缩时,会有 晶体和KMnO4晶体一起析出。
(5)在加热、浓缩、烘干的过程中温度不宜过高,其原因是 ;加热时用玻璃棒不停搅拌溶液的目的是 。
某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析小组成员从理论上分析,认为下列分解产物不可能的是 。
a.Fe2O3、SO3、H2O
b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为 。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热双通管。
③观察到A中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 。
结论2:C中溶液褪色,可推知产物中有 。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液
c.H2O2 d.NaOH溶液
【化学选修——有机基础化学】阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸) 与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林的化学方程式 。阿司匹林的含氧官能团的名称是___________,反应类型是_________。
(2)①合成阿斯匹林时,加饱和NaHCO3的作用是 。
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)检验产品中是否含有水杨酸的试剂和方法是 。
(4)该学习小组在实验中原料用量:4.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=4.6g,则所得乙酰水杨酸的产率为 。
(15)硫代硫酸钠(Na2S2O3)可用作照相业的定影剂、电镀业的还原剂、净水工程的净水剂。某校化学研究性学习小组欲通过制取硫代硫酸钠,并通过实验探究硫代硫酸钠的化学性质。
(1)实验室制取硫代硫酸钠的反应原理可表示为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2。该研究性学习小组利用如图所示装置制取Na2S2O3,其中NaOH溶液的作用是___________________;如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有________________(填化学式)杂质生成。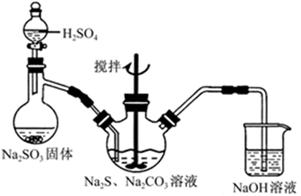
(2)用pH试纸检测硫代硫酸钠溶液的pH,正确的操作是_________________,测得溶液pH=8,根据盐溶液呈酸碱性的原理,用离子方程式解释可能的原因:____________________________;
(3)已知:S2O32-+2H+=S↓+SO2↑+H2O,市售硫代硫酸钠试剂中常含有硫酸根杂质,设计一个实验检验之。请完成下表:
| 实验步骤 |
预期现象 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
|
| 步骤2: |
|
| 步骤3: |
(4)Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol/L Na2S2O3进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL。部分反应的离子方程式为:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32--=2I-+S4O62-。
①以淀粉为指示剂,则达到滴定终点的现象是_________________;
②该废水中Ba2+的物质的量浓度为_______________________。
肉桂酸用途广泛,常被用作食品保鲜剂、食品添加剂、有机合成中间体等。其一种合成原理如下:
【实验步骤】
①向A中依次加入沸石、一定比例的苯甲醛、乙酸酐及少许碳酸钾。
②控制温度1500C~1700C,使其充分反应。
③向冷却后的三口瓶内加入饱和碳酸钠溶液,调节pH至9~10。
④如装置B所示,用水蒸气蒸馏,除去未反应的苯甲醛。
⑤加入活性炭,充分振荡并煮沸脱色。
⑥……
(1)装置A中冷凝管由 端(填“a”或“b”)通入冷凝水。
(2)步骤③中加入饱和碳酸钠溶液将肉桂酸、醋酸转化为肉桂酸钠和醋酸钠的原因: 。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为 ,玻璃管的作用为 。
(4)当观察到冷凝管中 ,说明水蒸气蒸馏结束。
(5)步骤⑥通过以下操作分离、提纯得较纯净的肉桂酸(难溶于水),其正确的操作顺序是 (填字母)。
a.重结晶 b.冷却、抽滤,水洗晶体
c.加入浓盐酸调节pH=3d.静置,趁热过滤得肉桂酸钠溶液
由于亚硝酸钠外观很像氯化钠而误作食盐使用引起中毒。某化学课外兴趣小组决定开展研究,寻求可行的方法,以鉴定某氯化钠样品中是否含有亚硝酸钠。为了解决这一问题,该小组查阅了大量的资料,对亚硝酸钠的相关信息归纳如下表:
| 亚硝酸钠 |
化学式为NaNO2,是亚硝酸(HNO2)的钠盐 |
| 物理 性质 |
白色至淡黄色粒状结晶或粉末,无味,易潮解,有毒,易溶于水,微溶于醇及乙醚,水溶液呈碱性,pH值约为9。密度:2.17g/cm3;熔点:271℃;沸点320℃(分解)。 |
| 化学 性质 |
氧化性:在酸性备件下能氧化KI,得到碘单质,自身被还原为NO气体 |
| 还原性:在酸性条件下能将KMnO4还原为Mn2+,自身被氧化为NO3- |
|
| 用途 |
抗氧化剂,防锈剂 |
某小组同学设计的方案如下:取少量固体,配成溶液。往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。如果溶液紫色褪去,说明该氯化钠样品中含有亚硝酸钠。
(1)写出上述设计方案的反应原理: 。(用离子方程式表示)
(2)亚硝酸钠溶液呈碱性的原因: 。(用化学方程式表示)
(3)该小组同学认为他们的方案还可测定样品中亚硝酸钠的含量。具体操作步骤如下:
a.称取一定量的样品,用25mL水溶解并置于锥形瓶中:
b.取酸性KMnO4溶液(过量)倒入锥形瓶中,振荡;
c.用草酸钠(Na2C2O4)溶液滴定过量的KMnO4;
d.重复上述操作。
①若每次实验时用到0.2000mol/L的酸性KMnO4溶液25.00mL,为减小试验误差,从中学角度看,量取酸性KMnO4溶液适宜使用的仪器是 。
②三次实验数据如下
| 实验次序 |
样品质量(g) |
滴定管中草酸钠溶液(浓度0.2500mol/L) |
|
| 滴定前滴定管读数(mL) |
滴定后滴定管读数(mL) |
||
| 1 |
5.0 |
0.00 |
12.78 |
| 2 |
5.0 |
1.50 |
14.32 |
| 3 |
5.0 |
1.25 |
15.05 |
己知:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O。
计算该样品中NaNO2的质量分数___(假设该样品中只含有NaC1和NaNO2)。
(4)根据上述信息和你所学过的化学知识,还可以设计其他实验方案以检验氯化钠样品中是否含有亚硝酸钠。试写出一种你所设计的方案(所用药品自行选择;简要写出实验操作、现象与结论、原理解释)
| 实验操作 |
现象与结论 |
原理解释(用离子方程式表示) |