从海水(含氯化镁)中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳[Ca(OH)2]
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物
④将得到的产物熔融电解得到镁。下列说法不正确的是
| A.此法的优点之一是原料来源丰富 |
| B.①②③步骤的目的是从海水中提纯MgCl2 |
| C.以上提取镁的过程中涉及分解、化合和复分解反应 |
| D.第④步电解不是氧化还原反应 |
下列有关化学用语能确定为丙烯的是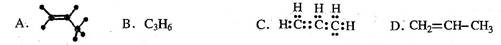
近期我国冀东渤海湾发现储量达10亿吨的大型油田,下列说法正确的是
| A.石油属于可再生矿物能源 | B.石油主要含有碳、氢两种元素 |
| C.石油的裂化是物理变化 | D.石油分馏的各馏分均是纯净物 |
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是( )
①ω= ②C=
②C=
③ 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
C(Cl-)>C(NH4+)>C(H+)>C(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
某澄清溶液中只含有以下可能存在的若干种离子:Na+、Fe3+、Fe2+、SO42-、Cl-、Ba2+、I-。现取部分溶液依次进行如下实验:①通入一定量氯气后,加入CCl4振荡,静置后CCl4层呈紫红色,用分液漏斗分液;②向分液后的水溶液中加入足量硝酸酸化的硝酸钡溶液,产生白色沉淀;③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀,向另一份中加入少量KSCN溶液,溶液立即变为红色。根据上述实验,以下推测正确的是( )
| A.原溶液一定显中性 |
| B.原溶液中肯定不存在的离子有Fe2+、Ba2+ |
| C.无法确定原溶液中是否存在Cl-、Na+、SO42- |
| D.原溶液中肯定存在的离子有Fe2+、SO42-、I- |
向氯酸钠的酸性水溶液中通入二氧化硫,反应中氧化过程为:SO2+2H2O–2e-→SO42-+ 4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- →2Cl-。在上述两个反应中均会生成产物X,则X可能是( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |