[化学——选修化学与技术]
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g)=SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出) 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
选修:化学与技术】(金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下: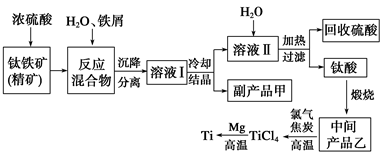
已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法:。
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理______________________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)。正确的检验方法是:取少量待测液,加入(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因。
(5)将粗K2FeO4产品经重结晶、过滤、、,即得较纯净的K2FeO4。
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)反应①为__________(选填“吸热”或“放热”)反应。
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为。
(3)下列关于反应①的说法正确的是。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
(10分) 氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现已知N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图如下左图。回答下列问题:
(1)该反应为(填“吸热”或“放热”)反应。
(2)合成氨的热化学方程式为。
(3)若又已知键能数据如上表,结合以上数据求出N-H键键能为kJ/mol。
(4)工业上,以氨气为原料生产硝酸的第一步为氨催化氧化,请写出该反应的化学方程式。
(10分)(I) 海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:
①在滤液中,滴加几滴硫酸和适量的双氧水②将海带烧成灰,向灰中加水,加热搅拌
③加CC14振荡、静置④过滤⑤分液。
(1)合理的操作顺序为。
(2)步骤③中要用到的玻璃仪器为,该步分离I2的操作叫。
(II)向某含有Fe2+、I—、Br—的溶液中缓缓通入适量氯气,溶液中各种离子的物质的量变化如图所示。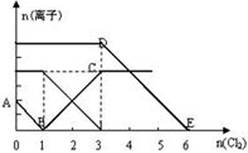
(3)AB段表示离子的减少。
(4)n(Cl2)=2mol时,溶液中反应的离子方程式为。