已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量二氧化碳的离子方程式: 2ClO-+CO2+ H2O |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E C.D>E>A>B D.D>A>B>E
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),△H< 0
2NH3(g),△H< 0
673K,30MPa下n(NH3)和n(H2)随时间变化的关系
如下图所示。下列叙述正确的是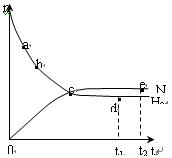
| A.点a的正反应速率比点b的大 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值小 |
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速率v=k(CH2)m(CCl2)n,式中k为常数,m、n值可用下表中数据确定。由此可推得的m、n值正确的是
| CH2 (mol·L-1) |
CCl2 (mol·L-1) |
v(mol·L-1·s-1) |
| 1.0 |
1.0 |
1.0k |
| 2.0 |
1.0 |
2.0k |
| 2.0 |
4.0 |
4.0k |
| A.m=1,n=1 | B.m=1/2,n=1/2 |
| C.m=1/2,n=1 | D.m=1,n=1/2 |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4 2NO2△H> 0)
2NO2△H> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,下列说法中正确的是:
①(a)甲>乙;②(a)甲<乙;③(b)甲>乙;④(b)甲<乙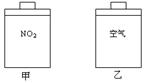
| A.①③ | B.①④ | C.②③ | D.②④ |
以下说法中正确的是
| A.△H<0的反应均是自发反应 | B.△S为负值的反应均不能自发进行 |
| C.冰在室温下自动熔化成水,是熵增的重要结果 | |
| D.高锰酸钾加热分解是一个熵减小的过程 |