某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:
(4)下图是某次滴定时的滴定管中的液面,其读数为 mL
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为________________
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律: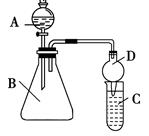
(3)仪器B的名称为________,干燥管D的作用为____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_________________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶除去。
某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2 mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 |
F.生成淡黄色沉淀 |
请帮助该同学整理并完成实验报告。
(1)实验目的:______________________。
(2)实验用品:______________________。
(3)实验内容:
| 实验方案 (填序号) |
实验现象 (填序号) |
有关化学方程式 |
(4)实验结论:_____________________。
(5)请用物质结构理论简单说明具有上述结论的原因___________________
(9分)O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究。
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处。
| 编号 |
实验目的 |
反应物 |
反应前溶液的pH |
温度 |
| 1 |
对照组 |
O3+NaI+H2SO4 |
5.2 |
25℃ |
| 2 |
①__________ |
O3+NaI+H2SO4+FeCl2 |
5.2 |
②_____ |
| 3 |
探究温度对反应速率的影响 |
O3+NaI+H2SO4 |
③_______ |
5℃ |
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol·L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液。
已知:①H2S2O3是一种弱酸;②2Na2S2O3+ I2= Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
②该实验中可选用_______(填物质名称)作指示剂。
③反应后溶液中碘的含量为_________ g·L-1。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
如图是某研究性学习小组设计制取氯气,并以氯气为反应物进行特定反应的装置。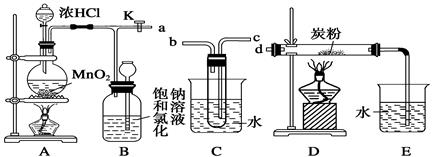
(1)要将C装置接入B和D之间,正确的接法是: a→→→d。
(2)实验开始时先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是,B的作用是。
(4)用量筒量取20 mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是(同上)。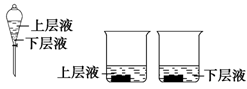
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由。
将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被H2O2还原,发生剧烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如下图。
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 仪器及 导管 |
 |
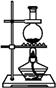 |
 |
 (一个) |
 (一个) |
 橡皮管 |
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图编号)是。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是。
(3)仪器①的橡皮塞上应有个孔,原因是。
(4)实验时,仪器①中除观察到红光外还有现象。
(5)实验需用约10% H2O2溶液100 mL,现用市售30%(密度近似为1 g·cm-3)H2O2来配制,其具体配制方法是。
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是。