某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO42-从右向左移动。下列分析不正确的是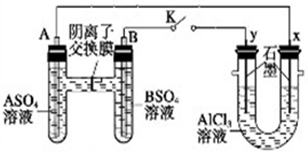
A、溶液中c(A2+)增大
B、B的电极反应:B2++2e-=B
C、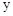 电极上有Cl2产生,发生氧化反应
电极上有Cl2产生,发生氧化反应
D、右边装置反应的离子方程式为:2Cl-+2H2O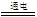 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气) 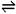 3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是
| A.4molA+2molB | B.2molA+1molB+3molC+1molD |
| C.3molC+1molD+1molB | D.3molC+1molD |
在密闭容器发生下列反应aA(g)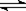 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3,ΔH="—92.4" KJ/mol,则N≡N键的键能是
| A.431 KJ/mol | B.946 KJ/mol | C.649 KJ/mol | D.869 KJ/mol |
在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO+O2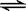 2NO2 2NO2 |
B.N2O4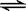 2NO2 2NO2 |
C.Br2(g)+H2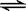 2HBr 2HBr |
D.6NO+4NH3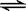 5N2+3H2O 5N2+3H2O |
下列按纯净物、混合物、电解质和非电解质顺序排列的是
| A.盐酸、空气、醋酸、干冰 |
| B.冰醋酸、福尔马林、硫酸钠、乙醇 |
| C.蛋白质、油脂、苛性钾、石灰石 |
| D.胆矾、漂白粉、氯化钾、硫酸钡 |