Ⅰ.维生素C的结构简式是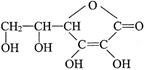 ,它的分子式是______________。由于它能防治坏血病,又称为_________________。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______________,说明维生素C具有_______________性。
,它的分子式是______________。由于它能防治坏血病,又称为_________________。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______________,说明维生素C具有_______________性。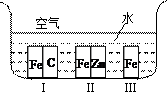
Ⅱ.(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2
上列的反应的总反应式是________________________,少量氟氯代烷能破坏大量臭氧的原因是___________________________________。
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ΔH= -570 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH= -483.68 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
(共18分)
(1)在同温同压下,等质量的CO和CO2,其体积之比为 ,电子数之比为 ,密度之比为 。
(2)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
(3)某金属氯化物MCl2 27g ,含有0.40molCl-,则该氯化物的物质的量为_ _____,摩尔质量为 ,金属M的相对原子质量为 。
(共13分)
(1)混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?
| A.分液 | B.过滤 |
| C.萃取 | D.蒸馏 |
E、蒸发结晶 F、加热分解
①除去Ca(OH)2溶液中悬浮的 CaCO3 ;②从碘水中提取碘 ;
③用自来水制取蒸馏水 ;④分离植物油和水 ;
⑤海水淡化 ;⑥除去 KCl 中少量 KClO3 ;
⑦熬煮中药 ;⑧用海水晒盐 。
(2)某同学要配制100mL 1mol·L-1NaCl溶液,配制时需选用的仪器主要有
, , , , 和试剂瓶。
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 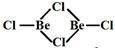
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。