NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是
| A.Li2NH中N的化合价为-1 |
| B.此法储氢和钢瓶储氢的原理相同 |
| C.LiH中的阳离子半径大于阴离子半径 |
| D.该反应中H2既是氧化剂又是还原剂 |
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
| A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+ |
| B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D.在含Fe 3+、 H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
有一块镁铝合金,其中镁与铝的质量比是8:9,加入足量稀硫酸使其完全溶解后,再加入NaOH 溶液,生成的沉淀的质量随NaOH 溶液体积变化的曲线如下图,其中正确的是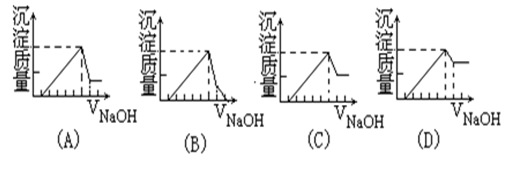
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
下列说法正确的是
| A.氨的催化氧化是一种特殊的固氮方式 |
| B.工业冶炼铝:电解熔融AlCl3固体 |
| C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
| D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大
| A.硫酸铝 | B.盐酸 | C.二氧化碳 | D.硫酸 |