常温时,将V1mL c1 mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列正确的是
| A.若混合溶液的pH=7,则溶液中c (NH4+)> c (Cl—) |
| B.若V1=V2,c1=c2,则溶液中一定存在c(H+)=c (OH—),呈中性 |
| C.若混合溶液的pH=7,则一定存在c1V1>c2V2 关系 |
| D.若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的 |
瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如下图所示,有关说法正确的是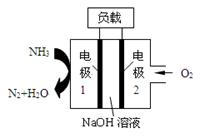
| A.电极2发生氧化反应 |
| B.电池工作时,Na+ 向负极移动 |
| C.电流由电极1经外电路流向电极2 |
| D.电极1发生的电极反应为:2NH3+6OH—-6e-=N2↑+6H2O |
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是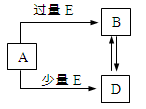
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是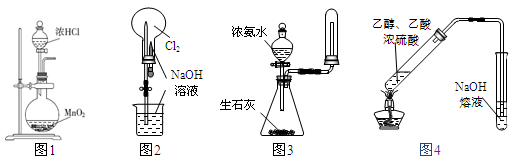
| A.用图1所示装置可制取Cl2 |
| B.用图2所示装置可完成“喷泉”实验 |
| C.用图3所示装置可制取并收集干燥纯净的NH3 |
| D.用图4所示装置可用于实验室制取乙酸乙酯 |
下列离子方程式正确的是
| A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH- |
| C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O CH3COO-+Cu2O↓+3H2O |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1mol甲醇中含有C—H键的数目为4NA |
| B.常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
| C.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA |
| D.80℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2 NA |