阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的方法是:以香兰素和丙二酸为原料,在C5H5N催化下生成阿魏酸。



(1) 阿魏酸的分子式是 ;1 mol该物质完全燃烧需消耗 mol O2。
(2) 关于上述三种物质,下列说法正确的是
| A.可用酸性KMnO4溶液检测反应后是否有阿魏酸生成 |
B.三种物质均可与Na2CO3溶液反应· |
| C.一定条件下,阿魏酸能发生取代、加成、消去反应 |
| D.0.5mol香兰素最多可以生成0.5molCu2O或与2molH2反应 |
E.丙二酸可由石油分馏产品中分离得到,其结构中有2种化学环境不同的氢原子
(3) 一定条件下,等物质的量的丙二酸与乙二醇之间脱水反应得到的化合物可能的结构有(写出两种)  。
。
(4) 已知在C5H5N催化及加热条件下,等物质的量的香兰素和丙二酸生成等物质的量的阿魏酸,试写出该有机反应的方程式。
。
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A |
|||||||||||||||||
| D |
E |
||||||||||||||||
| G |
Q |
M |
R |
||||||||||||||
| T |
|||||||||||||||||
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(3)M、D两种元素形成的化合物含有的化学键类型是,其分子是(填“极性”或“非极性”)分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式)。
A与D形成分子的空间结构可能是(填序号)。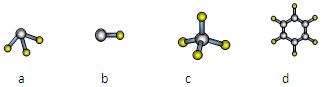
有A、B、C、D、E、F六种元素,已知:
①.它们位于三个不同短周期,核电荷数依次增大.
②.E元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
③.B与F分别同主族.
④.A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物.
⑤.B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
⑴写出A、B、C、D、E、F元素符号分别为___________________________________,
只含有A、B、D、E四种元素的两种无水盐的化学式 _____ ._____________.
(2)B2A2分子结构式______________中存在____个σ键,_____个兀键.
(3)下列四种物质形成的晶体,熔点由高到低的顺序(用a、b、c 、d表示):.
a.F与B形成的化合物 b.B与D形成的稳定化合物
c.F的单质 d. E与D形成的化合物
. (6分)碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过杂化与周围碳原子成键,多层碳纳米管的层与层之间靠结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为,每个Ba2+与个O2-配位。
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和族序数(A)有如下经验公式:K="A/n" (K为A与n的比值)。请选编号回答下列问题:
A.两性金属B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素;
当K=l时,则该元素系_________元素(n≠1);
当K<1时,则该元素系_________元素。
(每空1分,共6分)在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC晶体。
⑴ 其中只含有离子键的离子晶体是;
⑵其中既含有离子键又含有极性共价键的离子晶体是;
⑶其中既含有离子键,又含有极性共价键和配位键的离子晶体是;
⑷其中既含有离子键又含有非极性共价键的离子晶体是;
⑸其中含有极性共价键和非极性共价键的非极性分子是;
⑹其中含有极性共价键的原子晶体是。