(14分)近年来,我闽许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列做法中,有利于降低大气中的 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。
a. 直接用煤做燃料
b. 开私家车
c. 棺树造林以增加绿化面积
d. 研究、幵发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知:

请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:__________
(3) 利用电化学原理将CO、SO2R化为重要化工原料,装置如图所示:
①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_____极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:__________
(4) ①已知:密闭容器中, 条件下,
条件下,
 ,其平衡常数K=13.3。
,其平衡常数K=13.3。
当此反应达到平衡时,若 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体屮 ,
, ,则改变的条件是____________________
,则改变的条件是____________________
(每空2分,共10分)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于______________mol。
(每空2分,共6分)
某温度下水的离子积为KW =1×10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b= ;
(2)若所得混合液的pH=2,则a∶b= ;
(3)若所得混合液的pH=10,则a∶b= 。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
请回答下列问题:
(1)固体a的化学式为__________________,Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__________________、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1)______________________L(保留4位有效数字)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为____________________。
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O,当有6molH2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: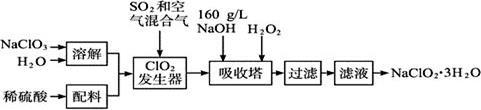
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1 L,其密度约为1.2g/mL。
(1)160 g·L-1 NaOH溶液的质量分数为 。
(2)发生器中鼓入空气的作用可能是_____________________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(3)ClO2发生器中的主要反应方程式为 ,吸收塔内的反应的化学方程式为 。
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____________(选填序号)。
a.Na2O2b.Na2Sc.FeCl2
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
a.蒸馏 b.蒸发 c.灼烧
d.过滤 e.冷却结晶