二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
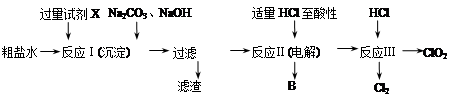
⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
简答题( 9分)(1)已知:C2H6O(g) + 3O2(g) ="=" 2CO2(g) + 3H2O(g)△H1
H2O(g)==H2O(l)△H2 ;
C2H6O(g)==C2H6O(l)△H3
若使1mol C2H6O(l)完全燃烧生成液态水,则放出的热量为(用符号表示)
(2)对于可逆反应CO(g)+H2O (g)  CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
①恒温恒压时,向容器中充入0.5mol的He,这时反应速率(填“加快”、“减慢”或 “不变”),原因是
②恒温恒容时,加入0.3mol的CO,这时反应速率(填“加快”、“减慢”或 “不变”),原因是。
简答题(7分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为;平衡时SO2浓度为;
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号);
| A.容器内气体的总压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2nmolSO2的同时消耗nmolO2 |
E.相同时间内消耗2nmolSO2的同时生成nmolO2
填空题( 6分)(1) ①C(s) + O2(g) ="=" CO2(g);ΔH= –393.5kJ/mol
②CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH= –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为____________________________。
(2)已知CH4的燃烧热为890kJ/mol,则24g CH4完全燃烧放出的热量为。
填空题( 24分)(1)25℃、101 kPa下,1 mol 氢气燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为___________________________________________________。
(2) 25℃,101kPa时,16 g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3 kJ热量,则CH4燃烧的热化学方程式为_______________________________________________。
(3)25℃,101kPa时,0.5 mol CO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为,其表示燃烧热的热化学方程式是。
(4)0.50L 2.00mol/L H2SO4与2.00L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为,其表示中和热的热化学方程式为。
(5)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,则25℃,101kPa时,N2与H2反应生成NH3的热化学方程式是。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A: 4HCl+O2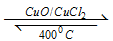 2Cl2+2H2O。
2Cl2+2H2O。
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii
①H2O的电子式是_______________.
②反应A的热化学方程式是____________________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),
分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是__________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度高低与投料比多少的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数__________。