下图中A至F是化合物,G是单质。
写出A、B、E、F的化学式:A____, B____, E____, F____。
含苯酚的工业废水处理的流程图如图所示:
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步
操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_________。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓)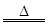 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)反应物中,氧化剂是________;化合价升高的元素是________。
(2)取一定体积的浓盐酸与MnO2发生反应,产生的氯气在标准状况下的体积为1.12 L(忽略Cl2的溶解)。则参加反应的HCl的物质的量是________;反应中被氧化的HCl的质量是________。(写出简要解题过程)
(1).等物质的量的CO和CO2中所含O原子个数之比,C原子数之比,二者的质量之比。
(2)下列物质中:(1)Cu(2) Br2⑶Na2O⑷蔗糖⑸NaCl溶液⑹ SO3⑺Ba(OH)2
属于电解质的是, 属于非电解质的是 ,能导电的是。(用序号填写)
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡________(填“向左”、“向右”或“不”)移动;此时溶液中 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入等浓度稀醋酸,使其恰好中和,写出反应的离子方程式:_________________;所得溶液的pH________7(填“>”、“<”或“=”),
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时[NH4+]=a mol·L-1,则c(SO42-)=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________________________________________。