香豆素类化合物具有抗病毒、抗癌等多种生物活性。香豆素 3
3 羧酸可由水杨醛
羧酸可由水杨醛
制备。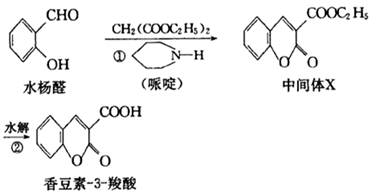
(1)中间体X的化学式为 。
(2)水杨醛发生银镜反应的化学方程式为 。
(3)香豆素 3
3 羧酸在NaOH溶液中彻底水解生成的有机物的结构简式为 。
羧酸在NaOH溶液中彻底水解生成的有机物的结构简式为 。
(4)下列说法中错误的是( )
| A.中间体X不易溶于水 |
| B.水杨醛分子中所有原子一定处于同一平面 |
| C.水杨醛除本身外,含有苯环且无其他环的同分异构体还有4种 |
D.水杨醛和香豆素 3 3 羧酸都能使酸性高锰酸钾溶液褪色 羧酸都能使酸性高锰酸钾溶液褪色 |
(5)反应①中的催化剂“哌啶”可以由“吡啶”合成,其反应为: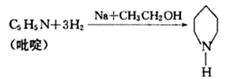
已知吡啶为环状,性质与苯类似。则吡啶的结构简式为 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 。