工业上处理含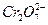 的酸性工业废水可用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀 ②用Fe为电极进行电解,经过一段时间有 Cr(OH)3和Fe(OH)3沉淀产生 ③过滤回收沉淀,废水达到排放标准
的酸性工业废水可用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀 ②用Fe为电极进行电解,经过一段时间有 Cr(OH)3和Fe(OH)3沉淀产生 ③过滤回收沉淀,废水达到排放标准
试回答:
(1)电解时的电极反应:阳极_____________________,阴极___________________________。
(2)写出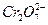 转变成Cr3+的离子反应方程式:_____________________________________。
转变成Cr3+的离子反应方程式:_____________________________________。
(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?________________________________。
(4)能否将Fe电极改成石墨电极?为什么?_________________________________________。
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去)。已知①图中每个小三角形的三种物质中至少含有一种相同元素,K与L、A与B分别含有相同的元素。②D,J为固体单质,R为气体单质,其余为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性。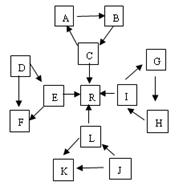
(1) J物质的化学式为,B所形成的晶体
为晶体,工业上要让B转化为C,与B反应的原料是。
(2)标况下,由E生成R 11.2 L时转移的电子数为。
(3)C+J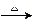 A+L的化学方程式为:。
A+L的化学方程式为:。
I+F→G的离子方程式为: 。
。
(4)常温下,测得一定浓度的G溶液的pH=10,试用离子方程式表示其原因 。
。
(5)J的最简单氢化物可与空气在碱性溶液中形成燃料电池,其负极电极反应式为。
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧,为了确定其生成产物并进行实验论证。某同学设计了下图所示装置进行实验(已知PdCl2能被CO还原得到黑色的Pd),请回答下列问题: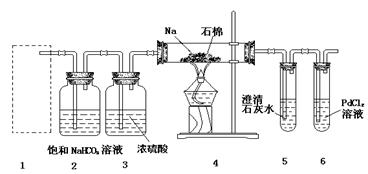
(1)为使反应随开随用,随关随停,方框内应选用下图所示装置(填字母代号)。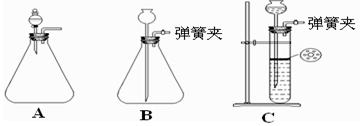
(2)实验室制取二氧化碳气体宜用的药品是(填标号)。
①石灰石,②纯碱,③小苏打,④18.4 mol·L—1硫酸,⑤11.2mol·L—1盐酸,⑥蒸馏水,⑦木炭粉。
(3)在2装置内进行反应的离子方程式为。检查装置气密性并装好药品后,点燃酒精灯之前待装置(填数字编号)中出现现象时,再点燃酒精灯。
(4)①若装置6中有黑色沉淀,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为;
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为。
已知物质M由 属于同一周期的X.Y两种短周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):
属于同一周期的X.Y两种短周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):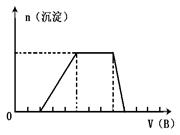
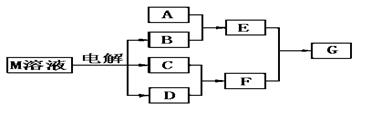
(1)已知元素Z与Y是最外层电子数相同的短周期元素,那么Z与Y分别与氢形成的氢化物中沸点较高的是(填化学式),原因是;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则E溶液与F溶液反应的离子方程式是:
;
(3)若A是与X、Y同周期元素的一种常见金属单质,且A与B溶液能够反应,则其化学方程式是:
;
(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则G的电子式是:
;
(5)若A是一种溶液,只可能含有H+.NH4+、 Mg2+、Fe3+、Al3+、CO32—、
Mg2+、Fe3+、Al3+、CO32—、
SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子是(微粒次序按摩尔质量从小到大,下同),物质的量浓度之比为。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下: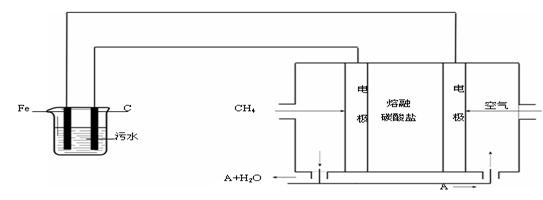
(1)上图中熔融碳酸盐中碳酸根离子的定向移动方向是 (填“向左”或“向右”)。实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① 。②4OH-- 4 e-= 2H2O + O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
(4分)将00C 101KPa条件下的氯化氢(HCl)气体44.8L,通入492mL水中,(已知水的密度为:1.00g/mL),得到密度为1.13g/mL的盐酸(即氯化氢的水溶液)。[
(1)求此盐酸的质量分数?(计算结果保留一位小数)
(2)求此盐酸的物质的量浓度? (计算结果保留一位小数)