下图是电解NaCl溶液(加有酚酞)装置,其中c、d为石墨电极。下列有关的判断正确的是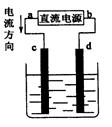
| A.a为负极、d为阳极 |
| B.c电极上的电极反应式为:2H+ + 2e一= 2H2↑ |
| C.电解过程中,d电极附近溶液变红 |
| D.电解过程中,氯离子浓度不变 |
 和
和 结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是()
结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是()
A. 的电子式为 的电子式为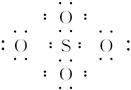 |
B. 中没有非极性键 中没有非极性键 |
C.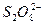 比 比 稳定 稳定 |
D.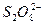 有强氧化性 有强氧化性 |
2006年6月8日,“基地”组织在伊拉克的头目扎卡维在美军一次空袭中被打死。扎卡维及其手下多次运用一种名为“N5”的爆炸性极强的“盐粒炸弹”进行恐怖爆炸。迄今为止,人们对“N5”的结构尚不清楚,只知道其实际上是带正电荷的分子碎片,若“N5”的空间结构呈V型对称,5个N原子最外层都达到8个电子结构,且含有2个N≡N,可将其视为“N5n+”,则n值为()
| A.1 | B.2 | C.3 | D.4 |
已知H2O2的分子空间结构可在二面角中表示,如图,则关于H2O2的说法正确的是()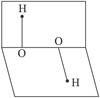
A.H2O2分子的电子式为:H+[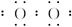 ]2-H+ ]2-H+ |
B.H2O2分子中共含14个电子 |
| C.H2O2是非极性分子 | D.H2O2分子正、负电荷重心不重合 |
近年来,科学家发现了一个由100个碳原子构成的具有完美对称性的C100原子团,其中每个C原子仍可形成4个化学键。内层是由20个C原子构成的正十二面体,每个C原子与相邻的3个C原子相连;外层的60个C原子形成12个分立的正五边形;处于中间层的C原子将内外层的所有C原子连接在一起。当它与氢或氟在适当条件下充分反应时,其形成的分子式应为( )
| A.C100H20和C100F20 | B.C100H60和C100F60 |
| C.C100H12和C100F12 | D.C100H40和C100F40 |
氰气的化学性质与卤素相似,故称为“拟卤素”,其化学式为(CN)2,且其分子有稳定的结构,推测其分子的结构式应为()
| A.N—C≡C—H | B.N="=C==C==N" | C.N≡C—C≡N | D.C—N≡N—C |