某化学实验小组 的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。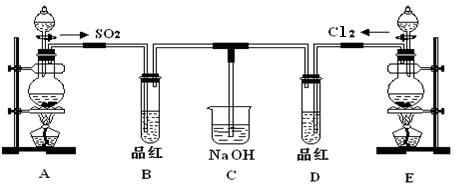
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗液体未流下,你认为原因可能是________________________________________________________
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
_________________________________________________________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B: _______________________,D:____________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)_____________________________________
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)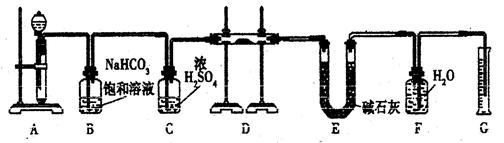
回答下列问题:
(1)装置A中液体试剂选用,理由是。
(2)装置B的作用是。
装置C的作用是。
装置E中碱石灰的作用是。
(3)装置D中发生反应的化学方程式是。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为。
实验室配制500ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量水至刻度线; | B.忘记将洗涤液转入容量瓶; |
| C.容量瓶洗涤后内壁有水珠而未作干燥处理; | |
| D.称量碳酸钠粉末时左盘放砝码,右盘放药品; |
E、定容时俯视刻度线。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式
(2)实验前必须对整套装置进行的操作是
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是
(4)干燥管中盛装的物质可以是,作用是
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是
(8分)用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有3 0mL水的100mL的容量瓶中,加水至刻度线
0mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(共14分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;
乙的作用是。
(3)反应进行一段时间后,干燥管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填试验操作名称)即可除去。