已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正 确的是( )
确的是( )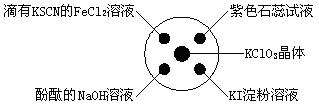
| 选项 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液变红色 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
| C |
石蕊溶液先变为红色后褪色 |
Cl2具有漂白性 |
| D |
KI淀粉溶液中变蓝色 |
Cl2具有氧化性 |
下列说法错误的是
| A.铝制品在生活中非常普通,这是因为铝非常不活泼 |
| B.铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护 |
| C.钠在空气燃烧时先熔化,再燃烧,最后所得的产物是Na2O2 |
| D.铁因在潮湿的空气中形成的氧化物疏松,不能保护内层金属 |
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图所示。下列说法正确的是
| A.试剂A为Na2SO4溶液 |
| B.生成沉淀1的离子方程式为:Cu2++2OH-=Cu(OH)2↓ |
| C.沉淀3的化学式可能是BaSO4 |
| D.生成沉淀2的离子方程式为:Ag++Cl-=AgCl |
胶体区别与其它分散系的本质是
| A.胶体粒子带电荷并且在一定条件下能稳定存在 |
| B.胶体的分散质粒子直径在1nm~100nm之间 |
| C.胶体粒子不能穿过半透膜,能通过滤纸空隙 |
| D.胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
与下列离子反应方程式相对应的化学方程式正确的是
| A.Cu2++2OH-=Cu(OH)2↓ CuSO4+2NH3·H2O= Cu(OH)2↓+(NH4)2SO4 |
| B.Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C.Cu+2Ag+=Cu2++2Ag Cu+2AgCl=2Ag+CuCl2 |
| D.Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 |
下列溶液中溶质的物质的量浓度为1mol/L的是
| A.将40gNaOH溶解于1L水中配成的NaOH溶液 |
| B.常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 |
| C.从1000mL1mol/LNaCl溶液中取出100mL的溶液 |
| D.将VL0.5mol/L的浓盐酸加热浓缩为V/2L |