室温下,把1mL 0.05mol/L的H2SO4加水稀释成1L溶液,在此溶液中由水电离产生的H+,其浓度接近于
| A.1×10-4 mol/L | B.1×10-8 mol/L |
| C.1×10-11 mol/L | D.1×10-10 mol/L |
设NA为阿伏加德罗常数的值,下列说法正确的组合是()
a 12 g 金刚石中含有的碳碳键的数目为2NA
b 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
e标准状况下,2.24 L C6H14含原子总数大于2NA
f17g H2O2中含有的电子数为9NA
g将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h常温下,100mL 1mol • L-1 AlCl3溶液中阳离子总数大于0.1NA
| A.a c f h | B.a c e g | C.a c e f h | D.b d e h |
下列各组描述正确的是
| A.化工生产要遵守三原则:充分利用原料、充分利用能量、保护环境。①燃烧时使用沸腾炉②制盐酸时将氯气在氢气中燃烧③制硫酸时使用热交换器这3种化工生产分别符合以上某原则 |
| B.① 用燃烧的方法鉴别甲烷、乙烯和乙炔②用酒精萃取溴水中的溴③ 用水鉴别硝酸铵和氢氧化钠固体④用互滴法鉴别Na2CO3、盐酸、BaCl2、NaCl四种溶液以上均能达到实验目的 |
| C.①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满以上操作均合理 |
| D.①过氧化氢:火箭燃料②碳酸氢钠:食品发酵剂③钠:制氢氧化钠④硫酸:制蓄电池以上物质的用途均合理 |
在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否则会引起安全事故。下列实验操作过程不是基于上述原因的是()
| A.用排水法收集气体后,先移出导气管,后熄灭酒精灯 |
| B.在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯 |
| C.在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤 |
| D.钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应 |
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是
| A.大力研发新型有机溶剂替代水作为萃取剂 |
| B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 |
| C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| D.甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳” |
元素周期表中铋元素的数据见图,下列说法正确的是()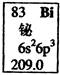
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层(能级)有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |