科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN三N键吸收941kJ热量,则
| A.N4的熔点比P4高 |
| B.1molN4气体转化为N2时要吸收724kJ能量 |
| C.N4是N2的同系物 |
| D.1molN4气体转化为N2时要放出724kJ能量 |
可逆反应aX(g)+bY(g)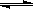 cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是()
cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是()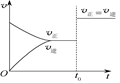
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大体系的压强 |
反应A+B→C(△H>0)分两步进行:①A+B→X(△H<0),②X→C(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )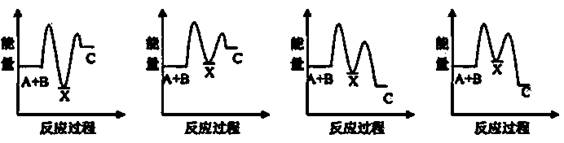
A B C D
对于A2+3B2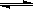 2AB3反应来说,以下反应速率表示反应最快的是()
2AB3反应来说,以下反应速率表示反应最快的是()
| A.v(AB3)=0.5 mol/(L·min) | B.v(B2)=0.6 mol/(L·min) |
| C.v(A2)=0.4 mol/(L·min) | D.无法判断 |
活化分子是衡量化学反应速率快慢的重要依据,下列对活化分子说法中不正确的是( )
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |
化学平衡常数(K)是化学反应限度的一个重要参数,该常数表示的意义是可逆反应进行的程度,K值越大,表示的意义错误的是()
| A.温度越高 | B.反应物浓度越小 |
| C.反应进行的越完全 | D.生成物浓度越大 |