常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;
此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点_____________ _;C点___ __ ________;
________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。
已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的相对分子质量比Z小16,乙与丙的相对分子质量相同,B的相对分子质量比D的小2,B与X的相对分子质量相同,各物质转化关系如右图(各反应条件已略去)。
(1)丙和B的化学式分别为__________________和__________________。
(2)Y转化为Z的化学方程式为__________________________________。
(3)B与D反应的化学方程式为__________________________________。
现有一重水(D2O)和水(H2O)的混合物(不是天然的纯水)。当m g这种水被电解时,电路上通过x mol电子,阳极收集到气体m1 g,阴极收集到气体m2 g(电解产物的溶解忽略不计)。
(1)若要求出重水的质量分数y,至少需要上述m、x、m1、m2等4个数据中的_______个。这些数据共有_____组,在下列橫线上分别列出(有多少填多少)____________________。
(2)从(1)中空格所填的数据中任取一组含m的数据,计算已被电解的水中D2O的质量分数y=_______。
下面是3种有机物结构式和名称(数字为碳原子编号):
用化合物(Ⅰ)为起始原料,经过3步主要反应可以得到化合物(Ⅱ)。
(1)请在以上3个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即系数)。
(2)从第(ii)步反应的化学原理看,它既发生了取代反应又发生了氧化还原反应,其中氧化剂是____;配平后的化学方程式中转移了____mol电子。
(3)请将反应式(iii)箭号下面的K2CO3改写在化学方程式的左端,重新另写出它的化学方程式,并配平之。____。
、
、
、
、
均为可溶于水的固体,组成它们的离子有
| 阳离子 |
|
| 阴离子 |
分别取它们的水溶液进行实验,结果如下:
①
溶液与
溶液反应生成白色沉淀,沉淀可溶于
溶液;
②
溶液与
溶液反应生成白色沉淀,沉淀可溶于
溶液;
③
溶液与
溶液反应生成白色沉淀,沉淀可溶于盐酸;
④
溶液与适量
溶液反应生成白色沉淀,加入过量
溶液,沉淀量减少,但不消失。
据此推断它们是
;
;
;
;
。
下图中A、B、C、D、E、F、G、H均为有机化合物。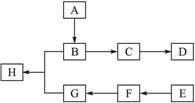
回答下列问题:
(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1 mol A在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是__________,由A生成B的反应类型是__________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是______________________________;
(3)①芳香化合物E的分子式是C8H8Cl2。E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式是____________________;
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)。1 mol G与足量的NaHCO3溶液反应可放出44.8 L CO2(标准状况),由此确定E的结构简式是________;
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是__________,该反应的反应类型是____________________。