美日三名化学家[理查德·赫克(Richard Heck,美)、根岸荣—(Ei – ich Negishi,日)、铃木章(Akira Suzuki,日)利用钯(Pd)作催化剂,将有机化合物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为(R – X中的R通常是不饱和烃基或苯环;R′CH=CH通常是丙烯酸酯或丙烯腈等):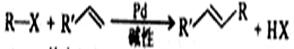
现有A、B、C、D等有机化合物 有如下转化关系:
有如下转化关系: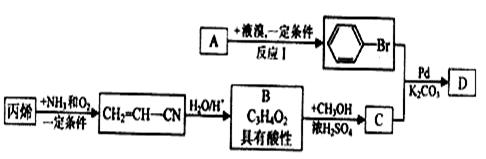
请回答下列问题:
(1)反应I的化学方程式为 。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加 氢的化学方程式: 。
氢的化学方程式: 。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为
。
(4)写出B转化为C的化学方程式: 。
(5)D的结构简式为 。
(6)D具有化学性质有(填编号) 。
A.加热能与氢氧化钠溶液反应
B.能使溴的四氯化碳溶液褪色
C.能发生缩聚反应和加聚反应
D.能使酸性高锰酸钾溶液褪色
(7)已知:醛基直接与苯环连接的醛如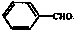 不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
①波谱分析显示分子中没有甲基;
②1,3,5—三取代苯;
③具有酸性,既能与Fe3+作用显色,又能使溴水褪色,易被新制的氢氧化铜氧化
现有以下物质:
①NaCl晶体②液态SO3 ③液态的醋酸④Cu
⑤BaSO4固体⑥蔗糖(C12H22O11)⑦酒精(C2H5OH)
⑧熔融的KNO3 ⑨纯水。
请回答下列问题(用序号):
(1)以上物质中能导电的是
(2)以上物质属于电解质的是
(3)以上物质中属于非电解质的是
(4)以上物质中属于弱电解质的是
写出下列化学反应对应的离子方程式:
(1)H2SO4和NaOH溶液反应
(2)向CuSO4溶液中加入铁粉
(3)AgNO3溶液与CaCl2溶液反应
(4)向澄清的石灰水中通入少量CO2
现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如下图):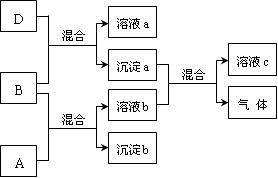
据此完成下列回答:
(1)写出各物质的化学式
A、 B、 C、 D、
(2)写出下列反应的离子方程式:
A + B反应:
沉淀a+溶液b:
(3)检验物质D中阴离子的方法为
(说明实验操作、现象与结论等)。
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水。
(1)服用适量的小苏打(NaHCO3),能治疗胃酸过多,该反应的离子方程式为:;
(2)如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是;
此时最好用含氢氧化稆的胃药(如胃舒平)离子方程式:。
(3)从物质的化学性质和溶解性角度看,Al(OH)3所属的类别分别是和。
下表中每组均有4个选项,请从中选出1个与另三种物质不属于同类的,并注明挑选依据。
| 组别 |
物质 |
不同类 物质序号 |
挑选依据 |
| (1) |
A.HCl B.CO2 C.NH3 D.CaO |
||
| (2) |
A.BaSO4 B.食盐水 C.NaOH D.熔融KCl |
||
| (3) |
A.CO2 B.SO2 C.CO D.P2O5 |
||
| (4) |
A.淀粉溶液 B.蔗糖水C.稀盐酸 D.75%医用酒精 |