在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生反应N2 + 3H2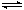 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x = ,y =  。
。
⑵若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上 述平衡完全相同。
述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为 。
完成银镜反应实验:在AgNO3溶液中逐滴加入氨水,开始时在AgNO3溶液中出现__________反应的离子方程式为____ ________________,继续滴入氨水则____ ____,反应的化学方程式为_______________________________边滴边振荡直滴到_____ _________为止.再加入乙醛溶液后,水浴中加热,现象是_______ _____,化学方程式为: ________________________
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。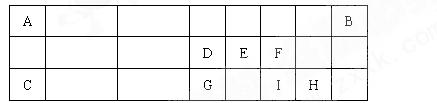
(1)上述元素的最高价氧化物的水化物的酸性最强的是_______(填化学式)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________的缘故。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________ ;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”),用电子式表示该化合物的形成过程_________________________________________ _。
_。
(4)现有另一种元素X,其原子获得一个电子的能力是上表中所列元素中最强的,则X是周期表中第_______ 族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_______(填字母序号)元素组成的,用化学方程式表示吸收原理:__________________________________________ 。
(6)设计实验方案:比较与I和H单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
下列反应属于放热反应的是_______;属于吸热反应的是_______。
| A.锌粒与稀H2SO4反应制取H2 | B.氢气在氧气中燃烧 |
| C.碳酸钙高温分解成氧化钙和二氧化碳 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应 F. C与CO2高温生成CO
G.葡萄糖在人体内 氧化分解 H.钢铁制品生锈的反应
氧化分解 H.钢铁制品生锈的反应
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的离子结构示意图为;化合物BA4的电子式为。
(2)化合物Y2X2 中含有的化学键类型有________(填序号).
中含有的化学键类型有________(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是_______(填化学式),其主要原因_____________________。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成A2X和Z单质,试写出化学方程式____________________。
氢能是21世纪极具开发前景的新能源之一,
它既是绿色能源,又 可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的
可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的 分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是能转化为能。
分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是能转化为能。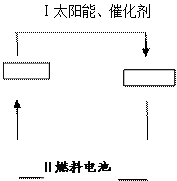
如果用KOH溶液作为电解质溶液,写出该燃料电池的电极反应式
负极:______________________________正极:_________________________________。[来