完成银镜反应实验:在AgNO3溶液中逐滴加入氨水,开始时在AgNO3溶液中出现__________反应的离子方程式为____ ________________,继续滴入氨水则____ ____,反应的化学方程式为_______________________________ 边滴边振荡直滴到_____ _________为止.再加入乙醛溶液后,水浴中加热,现象是_______ _____,化学方程式为: ________________________
电解原理在化学工业中有广泛应用。图2-20表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: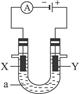
图2-20
若X、Y都是惰性电极,a是氯化钠饱和溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
(1)电解池中X极上的电极反应式为_____________________,在X极附近观察到的现象_____________________________________________________________________________。
(2)Y电极上的电极反应式为____________________________,检验该电极反应产物的方法是____________________________________________________________。
矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土〔Al2Si2O5(OH)4〕,此反应的离子方程式为2KAlSi3O8+2CO2+11H2O====2K++2 +4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
+4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
2004年10月1日,南昌八一广场以全新的面貌重新向市民开放,成为南昌的一大亮点。在这次改造扩建的过程中采用了大量的花岗石(不与常见酸反应)和大理石。要区别这两种石料,正确的操作是________________________________________________。
氮化硅是一种超硬物质,抗腐蚀能力强,还能抗冷热冲击。工业上可用高纯硅与纯氮气在高温下反应制取。
(1)根据氮化硅的性质,推测其用途是____________(填序号)。
| A.制造永久性模具 |
| B.制汽轮机叶片 |
| C.制石英玻璃 |
| D.制造柴油机 |
(2)根据氮和硅在周期表中的位置,写出氮化硅的化学式:____________。
(3)氮化硅可被氢氟酸腐蚀,生成四氟化硅和氨。试写出该反应的化学方程式:__________________________________________________。
A为药用有机物,从A出发可发生图3-1所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
图3-1
试完成:
(1)A转化为B、C时,涉及到的反应类型有____________、____________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能跟金属钠反应放出氢气,而Q不能。Q、R的结构简式分别为:Q____________,R____________。
(3)气体X的化学式为____________,D的结构简式为____________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为:________________________。