A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的离子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2 中含有的化学键类型有________ (填序号).
中含有的化学键类型有________ (填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是_______ (填化学式),其主要原因_______ _______ _______ 。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成A2X和Z单质,试写出化学方程式____________________ 。
(共10分)常温下,如果取0.1 mol HA溶液与0.1mol
HA溶液与0.1mol  NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);
(共14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2 molN2;的和0.6 molH2的,在一定条件下发生反应: ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。
,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v( N2)=____。
(2)平衡后,若要提高H2的转化率,可以采取的措施有______。
A.加了催化剂B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应: ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较 、
、 的大小,
的大小, ____
____ (填“<”、“>”或“=”):
(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应 的化学平衡常数为____。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和1 mol时,则该反应的
的化学平衡常数为____。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和1 mol时,则该反应的 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是____。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为  ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)己知: 

则反应 
有七种物质:① 铝,② A12O3,③ 稀硝酸,④ NaHCO3,⑤ Ba(OH)2固体,⑥ 氨水,⑦ A12(SO4)3,根据下列要求回答问题:
(1)属于电解质的是(填序号)。
(2)既能与强酸反应,又能与强碱反应的是(填序号)。
(3)34.2 g ⑦ 溶于水配成500 mL溶液,溶液中SO42-的物质的量浓度为。
(4)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的物质的量之比是。
(12分)(1)现用氯化铜晶体(CuCl2.2H2O,含少量FeCl2杂质)制取纯净的CuCl2.H2O先将其制成水溶液,后按如图步骤进行提纯: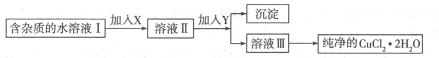
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表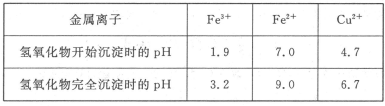
请回答下列问题:
①请从下列物质中选出第一步中需加入的X
a.NaClOb.H2O2
c.KMnO4d.HNO3
②如何检验溶液Ⅱ中除Cu2+外的金属阳离子:________________________________。
③由溶液Ⅲ得到CuCl2.2H2O晶体的操作是___________________________________.
(2)某化学兴趣小组取一定量的双氧水,欲准确测定其中H2O2的含量:
取双氧水25. 00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准溶液滴定,其反应的离子方程式为: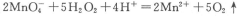
(1)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中,滴定到达终点的现象是________________________________________________
(2)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”或“偏低”或“不变”)。