(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为  ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 

则反应 
研究
、
、
等大气污染气体的处理具有重要意义。
(1)
可用水吸收,相应的化学反应方程式为。利用反应
 也可处理
。当转移1.2
电子时,消耗的
在标准状况下是L。
也可处理
。当转移1.2
电子时,消耗的
在标准状况下是L。
(2)已知:

 则反应
则反应
 的
。
的
。
一定条件下,将
与
以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.
和
的体积比保持不变
d.每消耗1
的同时生成1
测得上述反应平衡时
与
体积比为1:6,则平衡常数K=。
(3)
可用于合成甲醇,反应方程式为
 。
。
在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填">"或" <")。实际生产条件控制在250℃、1.3×104
左右,选择此压强的理由是。

白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
已知:
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是_。
(2)
的反应类型是;
的反应类型是。
(3)化合物
不与
溶液发生显色反应,能与
反应放出
,推测其核磁共振氢谱(
)中显示有种不同化学环境的氢原子,其个数比为。
(4)写出
反应的化学方程式
(5)写出化合物
、
的结构简式:
,
。
(6)化合物 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。
室安卡因(
)是一种抗心率天常药物,可由下列路线合成

(1)已知
是 的单体,则
中含有的官能团是(写名称)。
的结构简式是。
的单体,则
中含有的官能团是(写名称)。
的结构简式是。
(2)
的名称(系统命名)是,
与足量
醇溶液共热时反应的化学方程式是。
(3)
是
的同分异构题,
分子中含有苯环,且苯环上一氯代物只有两种,则
所有可能的结构简式有 、、。
、、。
(4)
的反应类型是。
(5)下列关于室安卡因(
)的说法正确的是。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸
、
、
、
是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;
和
原子的核外电子数相差1;
的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
(1)
位于元素周期表中第周期第族;
的基态原子核外有个未成对电子。
(2)
的单质子和Y的单质相比,熔点较高的是(写化学式);
的气态氢化物和溴化氢相比,较稳定的是(写化学式)。
(3)
与
形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是。
(4)在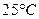 、101
下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1
电子放热190.0
,该反应的热化学方程式是。
、101
下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1
电子放热190.0
,该反应的热化学方程式是。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质

填写下列空白:(1)甲中不含氧原子的官能团是;下列试剂能与甲反应而褪色的是(填标号)
a. 溶液 b.石蕊溶液 c.酸性 溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:
(3)淀粉通过下列转化可以得到乙(其中A-D均为有机物):

的分子式是,试剂 可以是。
(4)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与 溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为。