【化学一有机化学基础 】
已知: (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是________,名称是________。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是 ,该反应类型是____ ____反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:________、 。
(5)A转化为B和F的化学方程式是 。
灰锡(结构松散,常粉末状存在)和白锡(坚固耐用),是锡两种同素异形体.
已知:Sn(s,灰) Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是℃((填“ >”、“ < ”或“=”)
Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是℃((填“ >”、“ < ”或“=”)
用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ·mol-1
H2(g)+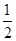 O2(g)=H2O(l)△H=-285.84kJ·mol-1
O2(g)=H2O(l)△H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热方程式为
已知Fe3+与I-在水溶液中发生:2I-+2Fe3+=2Fe2++I2。该反应正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+)(其中k为常数)。
| cm(I-)(mol/L)m |
cn(Fe3+)[(mol/L)n] |
v[mol/(L·s)] |
|
| a |
0.20 |
0.80 |
0.032 |
| b |
0.60 |
0.40 |
0.144 |
| c |
0.80 |
0.20 |
0.128 |
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填大于或小于或等于)
已知下列反应的平衡常数:
(1)HCN H+ + CN-,K(1)Θ =" 4.9" ×10-10
H+ + CN-,K(1)Θ =" 4.9" ×10-10
(2)NH3 + H2O  NH4+ + OH-,K(2)Θ =" 1.8" ×10-5
NH4+ + OH-,K(2)Θ =" 1.8" ×10-5
(3)H2O H+ + OH-,KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-,KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-,反应平衡常数的K值是_________________
NH4+ + CN-,反应平衡常数的K值是_________________
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________