选考题[化学—选修2:化学与技术]
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为: ,该反应在 中进行(填仪器名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填仪器名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填仪器名称)用 吸收,得到浓硫酸或发烟硫酸。
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,
结合工业生产实际,选择最合适的生产条件是 。
(4)现在欲提高SO2的反应速率和转化率,下列措施可行的是 。
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(5)由吸收塔排出的尾气中有SO2的含量如果超过500μL/ L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
(1)在密闭容器里,通入x mol SO2和y mol O2,发生化学反应:2SO2 (g) + O2 (g) 2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
①降低温度____________________ ;
②当容器容积不变,充入更多的O2 ____________________ ;
③当容器容积不变,通入氖气____________________。
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是____________________(填序号)。
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有____________________ 个。
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式________________________________________。
下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白。
| 族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
③ |
④ |
||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)单质性质最不活泼的元素的某种核素,核内有21个中子,则该核素的原子符号为____________________。
(2)①~⑩中非金属性最强的元素在元素周期表中的位置为____________________。
(3)第二周期元素的最高价氧化物对应水化物中,酸性最强的是____________________(填化学式)
(4)⑤⑥⑦三元素的最高价氧化物对应水化物的碱性由强到弱的顺序为(填化学式):
________________________________________ 。
(5)③④⑨三元素的氢化物的沸点由高到低的顺序为(填化学式)____________________。
根据下面的有机物合成路线回答下列问题: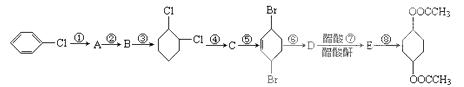
(1)写出B、C、D的结构简式:B______________,C_______________,D________________;
(2)其中属于取代反应的有_________________,属于加成反应的有______________。
(3)写出反应④的化学方程式___________________________________。
下图是维生素A的分子结构: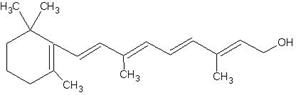
(1)维生素A中的含氧官能团是(写名称);
(2)维生素A的分子式是;
有A、B、C三种烃的衍生物,相互转化关系如下:
其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体,则:
(1)推断A、B、C的名称依次是:_________、____________、______________-。
(2)写出下列反应的化学方程式
A→B _________________________________
B→C ________________________ __________
B→A __________________________________
B的银镜反应___________________________________