下列事实能判断金属元素甲的金属性一定比乙强的有
①甲单质能与乙盐的溶液反应 ②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙 ③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气 ⑤两单质分别与氯气反应时生成的阳离子,乙失去的电子数比乙多
| A.全部可以 | B.仅②不可以 | C.仅②⑤不可以 | D.③④可以 |
锰酸钾可用于油脂、纤维、皮革的漂白等,其可由KOH、KClO3和MnO2经共熔制备,反应原理为6KOH+KClO3+3MnO2 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
| A.KOH和KCl中均含有共价键 |
| B.MnO2在反应中被还原 |
| C.K2MnO4的氧化性大于KClO3 |
| D.该反应中,每生成3 mol K2MnO4转移的电子数为6×6.02×1023 |
有如下变化:A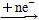 An- ΔH1<0,B
An- ΔH1<0,B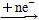 Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
| A.氧化性:A<B | B.还原性:An-<Bn- |
| C.稳定性:B<A | D.稳定性:An-<Bn- |
下列说法正确的是( )。
| A.反应Na→Na2O→Na2O2中钠元素被连续氧化 |
| B.1 mol金属钠发生反应Na→Na2O和发生反应Na→Na2O2转移电子数相等 |
| C.1 mol Cl2与足量Fe反应转移3 mol电子 |
| D.将1 mol Cl2通入1 L水中转移的电子为1 mol |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82—+H2O―→MnO4—+SO42—+H+。下列说法不正确的是 ( )。
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82—>MnO4— |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
下列离子方程式书写正确的是 ( )。
| A.Fe3O4溶于足量稀HNO3:3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O |
| B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |