B、D、E为中学化学常见的单质,其中D、E为金属。在一定条件下C、D间能发生反应。各物质转化关系如下图: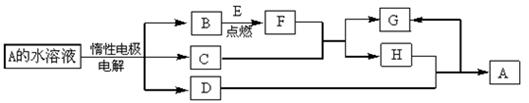
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知1g E在氧气中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入8.0g A的氧化物后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。
生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水 。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为 。 (不用写反应条件)
(3)下列属于乙醇的同系物的是 ,属于乙醇的同分异构体的是 。(选填编号)
C.CH3 CH2—O—CH2CH3 D.CH3OH
E.CH3—O—CH3 F.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗________mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化,反应的化学方程式为_____________________。
③下列说法正确的是________(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物将乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
(1) 证明溴乙烷中溴元素的存在,有下列几步,其正确的操作顺序是___ _____。
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性
(2)有机物M结构如下图,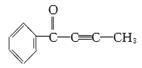 。根据M的结构回答:M中不饱和碳原子有
。根据M的结构回答:M中不饱和碳原子有
个,最多有 个原子共平面。
(3)某烃A和炔烃B的混合物共1L,完全燃烧生成相同状况下的二氧化碳1.4L,水蒸气1.6L,写出两种烃的结构简式.A ;B ,两者物质的量之比为A :B = 。
(4)实验室制取硝基苯的化学反应方程式是 ;试剂加入顺序是 ,该反应需要控制温度,方法是 。
根据所学知识填空:
(1)烷烃的同分异构体之间,支链越多,沸点 ;烷烃均 溶于水,密度均比水 。
(2)苯酚常温下在水中的溶解度 ,苯酚有毒,对皮肤有强烈的腐蚀作用,如果不慎沾到皮肤上应立即用 洗涤。
(3)乙烯是石油裂解的主要产物之一。将乙烯通入溴的四氯化碳溶液中,观察到的现象是______,其反应方程式为_______________。乙烯在一定条件下发生加聚反应的化学方程式是_______________,其产物的名称是_____________;乙烯对水果具有________功能。
(4)北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如下图,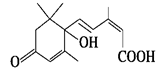 。根据S诱抗素结构,可知S诱抗素分子中含有的官能团有 、 、 、 。
。根据S诱抗素结构,可知S诱抗素分子中含有的官能团有 、 、 、 。
现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④淀粉溶液 ⑤氨基酸。请回答:
(1)遇碘水呈蓝色的是 (填序号,下同)。
(2)能发生成肽反应的是 。
(3)能跟溴发生加成反应的是 。
(4)能跟银氨溶液发生银镜反应的是 。
(5)能跟饱和溴水反应生成白色沉淀的是 。
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ•mol-1) |
786 |
715 |
3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__________,Na、Mg、Al第一电离能I1从小到大的排列顺序是____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是_________________。
②SO42-中S原子的杂化类型是,与其互为等电子体的分子有________(任写一种)。
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有__(填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式;金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是_____g/cm3(列出计算式)。