电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为____________,
在X极附近观察到的现象是 :______________________;
Y电极上的电极反应式是_________________________,
检验该电极反应产 物的方法是:_______________________________。
物的方法是:_______________________________。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,电极反应式是________________________。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。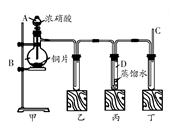
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是,该装置中发生反应的化学方程式为。
(2)实验过程中,装置乙、丙中出现的现象分别是;装置丙中的试管内发生反应的离子方程式为。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为色。
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答: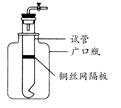
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?。该反应的离子方程式是:。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制氧气 |
H2O2―→O2 |
|
| ② |
制氨气 |
NH4Cl―→NH3 |
|
| ③ |
是氯气 |
HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。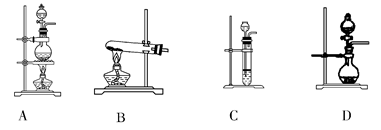
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的________(填序号):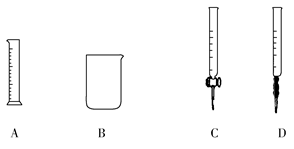
②配制过程中,除上图所列仪器外,还需要的仪器有________、________、________。
请你利用下列装置来证明浓硫酸与足量锌反应时可得到SO2、H2两种气体,所需试剂自选。
(1)在下面的方框中,画出实现上述实验目的的装置示意图(仪器选自于下图,夹持装置、连接胶管、橡皮塞及尾气处理装置不必画出,也不必标出装置内试剂,需要加热的仪器下方用△标出),按气流流向在每件仪器下方标出字母A、B、C……其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,填写下表:
| 仪器符号 |
仪器中所加物质 |
作用 |
| 最后一种装置(作图时请对其编号) |
浓硫酸 |
防止空气中水蒸气进入E中干扰实验 |
有一瓶澄清的溶液,其中可能有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Cl-、I-、NO3-、CO32-、S2-、SO42-、AlO2-、MnO4-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性,可以排除________离子的存在;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫色,可以排除________离子的存在;
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除________离子的存在;
(4)取出部分上述碱性溶液滴加Na2CO3溶液后,有白色沉淀生成,证明________离子存在,又可排除________离子的存在;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。根据上述实验事实确定:该溶液中肯定存在的离子是________,还不能确定是否存在的离子是________。