有机物A无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为: 。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分 别增重5.4g和13.2g。 别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)A中含有官能团的名称: 。 |
(4)A的核磁共振氢谱如下图: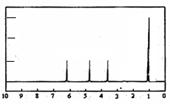 |
(4)A中含有 种氢原子。 |
| (5)综上所述,A的结构简式为: 。 |
(6分)在①盐酸、②浓硝酸、③氨水、④稀硫酸、⑤氢氧化钠溶液五种物质中,
(1)可用于除去Fe2O3粉末中混有的少量Al2O3的是 (填序号,下同);
(填序号,下同);
(2)可用于除去Al表面的铜镀层的是,发生反应的化学方程式是。
材料是科学进步 的关键,不同的化学物质有不同的用途。现有①氯气、②氨气、③单质硅、④水玻璃四种物质。其中可以用作制冷剂的是
的关键,不同的化学物质有不同的用途。现有①氯气、②氨气、③单质硅、④水玻璃四种物质。其中可以用作制冷剂的是 ;常用作木材防火剂材料的是;可以用来消毒杀菌的是。(填序号)
;常用作木材防火剂材料的是;可以用来消毒杀菌的是。(填序号)
有以下一系列反应,终产物为草酸,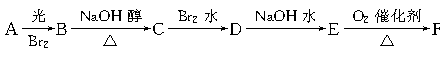
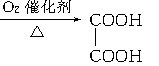
已知B的相对分子质量比A的大79
(1)写出下列步骤的反应类型
A→B:___________ B→C:___________ C→D:___________
(2)写出下列步骤反应的化学方程式
C→D:__________________________________________
E→F:__________________________________________
有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示: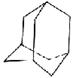
(1)由图可知其分子式为:____________,一氯代物有_______种。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
(10分) 现有①苯;②甲苯;③氯苯;④苯酚;⑤乙烯;⑥乙醇。其中:
(1)能和金属钠反应放出氢气的有
(2)能和NaOH溶液反应的有
(3)常温下能和浓溴水反应的有
(4)用于制取TNT的是
(5)能使酸性KMnO4溶液褪色的是