右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有: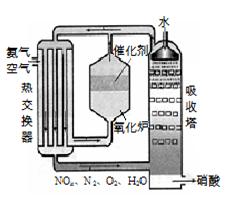
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
| A.适当升高温度 |
| B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 |
| D.吸收塔内填充瓷环,增大气液接触面 |
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/c m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
【化学——选修3:物质结构与性质】(10分) 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为_______________________。
(2)硝酸钾中NO3-的空间构型为____________________,写出与NO3-互为等电子体的一种非极性分子化学式_______________。
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有______________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(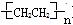 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
| 化学键 |
Si—Si |
O==O |
Si—O |
| 键能(kJ·mol-1) |
a |
b |
c |
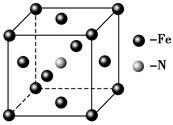
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式________________。若两个最近的Fe原子间的距离为s cm,则该晶体的密度是____________g·mol-1。
【化学—选修2:化学与技术】生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。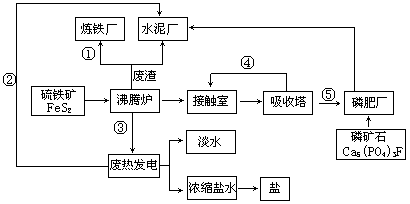
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
(10分)如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
(1)从装置的特点判断,甲、乙装置中 是原电池,其负极的电极反应式为: ;
(2)实验开始后,(乙)装置中有关电极反应是:C: ;D: ,D电极上的现象是 ,一段时间后溶液中的现象是 ;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为: ,乙装置里除两电极上有明显的现象外,还可以看到的现象是 ,产生该现象的化学反应方程式是 。
(10分)高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(4)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(5)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
(10分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
(1) 达到平衡所需时间,A容器比B容器___________,两容器中SO2的转化率A比B______________。
(2) 达到(1)所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡____________移动。
(3) 达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________________,B容器中SO3的体积分数__________________(填变大、变小、不变)。