完成下列反应的化学方程式,并指出反应类型.
(1)由乙烯制取聚乙烯:
________________________________________________________________________,
(2)由丙烯制取聚丙烯:
________________________________________________________________________,
(3)由对苯二甲酸(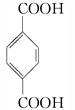 )与乙二醇发生反应生成高分子化合物:
)与乙二醇发生反应生成高分子化合物:
______________________________________,________________________.
(5分)X、Y、Z是ⅠA--ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示。试完成下列问题: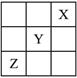
(1)X元素单质的化学式是__________。
(2)Y元素的原子结构示意图是__________,Y与Na所形成化合物的电子式为__________。
(3)Z元素的名称是__________,其价电子排布式为__________。
(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。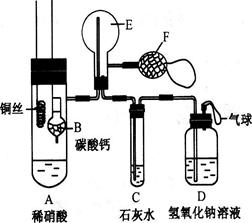
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作。
如何确定E中空气已被赶尽:__________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________
已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E(分子式为C4H8O2),其合成路线如下图所示。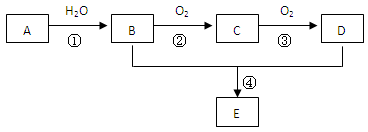
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的化学方程式:
①;反应类型:。
④;反应类型:。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有和。
(2)锌与盐酸反应速率可以通过观察进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是或。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因。
(9分)(1)按下图装置进行实验,可观察到的现象有:。其中Zn极发生反应(填“氧化”或“还原”),写出电极反应式。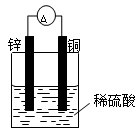
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2溶液,气泡放出的速率加快。其原因是。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。